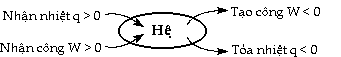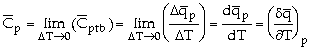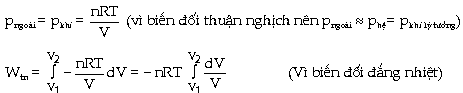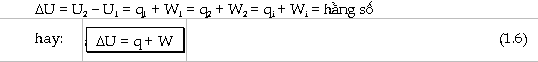|
NGUYÊN LÝ THỨ NHẤT NHIỆT ÐỘNG HỌC |
|
Nhiệt động học là ngành vật lý nghiên cứu
dạng nhiệt của chuyển động vật chất và những qui luật của chuyển
động đó. Nhiệt hóa học là một phần của nhiệt động học nhằm mục đích
khảo sát sự trao đổi năng lượng đi kèm theo những biến đổi vật lý,
hóa học của vật chất. Nhiệt hóa học giúp tiên đoán trong một số
trường hợp một biến đổi có thể xảy ra được hay không. I. MỘT SỐ KHÁI NIỆM
Hệ là một phần của vũ trụ có giới hạn xác
định đang được khảo sát về phương diện trao đổi năng lượng và vật
chất. Phần còn lại của vũ trụ là môi trường ngoài đối với hệ. Thí dụ: Một hỗn hợp gồm hai hóa chất đang
cho phản ứng trong một ống hàn kín. Hệ là các chất hiện diện trong
ống, giới hạn của hệ là vách ống, phần vũ trụ ngoài ống là môi
trường ngoài. Hệ có thể trao đổi nhiệt, công, vật chất
với môi trường ngoài. Thí dụ: Hệ gồm kim loại kẽm đang cho phản ứng với dung dịch HCl trong một becher:
Khí H2 thoát ra khỏi becher:
hệ mất vật chất. Phản ứng tỏa nhiệt: hệ cung cấp nhiệt cho môi
trường ngoài. Có ba loại hệ: - Hệ hở (hệ mở): là hệ có thể trao đổi cả
năng lượng lẫn vật chất với môi trường ngoài. Thí dụ: đun sôi một ấm nước, nhiệt được
cung cấp vào hệ, hệ mất vật chất ra môi trường ngoài dưới dạng hơi
nước. - Hệ kín (hệ đóng): là hệ chỉ trao đổi
với môi trường ngoài năng lượng nhưng không trao đổi vật chất. Thí dụ: hệ gồm các hóa chất đang cho phản
ứng trong một ống thủy tinh hàn kín. Hệ không mất vật chất nhưng có
thể nhận nhiệt vào (nếu phản ứng thu nhiệt) hoặc cung cấp nhiệt (nếu
phản ứng tỏa nhiệt). - Hệ cô lập: là hệ không trao đổi cả
năng lượng lẫn vật chất với môi trường ngoài. Thí dụ: một bình Dewar chứa hóa chất được
đậy kín và được bao phủ bằng một lớp cách nhiệt thật dày để cho vật
chất và nhiệt lượng không thể trao đổi với môi trường ngoài. Trạng thái là một từ nói lên đặc điểm của
hệ đang được khảo sát. Một hệ có trạng thái xác định khi những biến
số xác định những đại lượng của hệ được biết một cách chính xác như
nhiệt độ, thể tích, áp suất, khối lượng riêng... các đại lượng này
được gọi là biến số trạng thái của hệ. Trạng thái của hệ sẽ thay đổi
nếu ít nhất có một trong những biến số trạng thái thay đổi. Thí dụ: 50cm3 nước ở 20°C,
1atm cho biết trạng thái của hệ nước đang xét. Chú ý trạng thái ở đây khác với trạng
thái tập hợp của vật chất (pha, tướng) là rắn, lỏng, khí. Thí dụ hệ nước trên được đun nóng đến
50°C, cũng ở áp suất 1atm thì hệ này đã có trạng thái khác: thể tích
nước lớn hơn 50cm3 một ít, nhiệt độ 50°C, áp suất 1atm.
Nhưng trong cả hai trạng thái của hệ nước trên thì nước của hệ đều ở
pha lỏng. Một hệ nhiệt động học biến đổi (hay thực
hiện một quá trình) khi trạng thái của hệ thay đổi. Trạng thái của
hệ thay đổi nếu ít nhất có một biến số trạng thái của hệ thay đổi.
Biến đổi được xác định nếu biết rõ trạng thái đầu và trạng thái
cuối. Ðường biến đổi chỉ được xác định khi biết được trạng thái đầu,
trạng thái cuối và tất cả những trạng thái trung gian mà hệ đã trải
qua. Người ta chia ra các loại biến đổi: - Biến đổi hở (mở): là biến đổi đem hệ từ
trạng thái đầu đến trạng thái cuối khác nhau. - Biến đổi kín (đóng): là biến đổi đem hệ
từ trạng thái đầu đến trạng thái cuối giống nhau. Trường hợp này, hệ
đã thực hiện một chu trình biến đổi kín. Thí dụ: 50cm3 nước ở 20°C,
1atm được đun nóng đến 70°C, 1atm rồi lại được làm nguội về 20°C,
1atm. - Biến đổi thuận nghịch: là biến đổi mà
các trạng thái trung gian của hệ trải qua được xem như do các quá
trình cân bằng. Một cách đơn giản để xác định tính chất thuận nghịch
của một biến đổi là khảo sát xem biến đổi ngược lại có thể xảy ra
được hay không khi chỉ thay đổi rất ít điều kiện thực nghiệm. Nếu
biến đổi ngược xảy ra được thì đó là biến đổi thuận nghịch, nếu biến
đổi ngược không xảy ra được thì đó là biến đổi bất thuận nghịch (hay
biến đổi tự nhiên). Thí dụ: sự truyền nhiệt từ nguồn nóng
sang nguồn lạnh là một biến đổi bất thuận nghịch hay tự nhiên vì
biến đổi ngược lại, tức sự truyền nhiệt từ nguồn lạnh sang nguồn
nóng không thể thực hiện một cách tự nhiên. Sự rơi tự do dưới tác
dụng của trọng trường cũng là một biến đổi tự nhiên hay bất thuận
nghịch. Sự đông đặc của nước ở 0oC, 1atm là một
biến đổi thuận nghịch vì biến đổi ngược lại ứng với nước đá nóng
chảy ở 0oC, 1atm cũng có thể thực hiện được. - Biến đổi đẳng tích: là biến đổi được
thực hiện trong điều kiện thể tích của hệ không thay đổi. Thí dụ: một phản ứng hóa học được thực
hiện trong ống hàn kín. - Biến đổi đẳng áp: là biến đổi được thực
hiện trong điều kiện áp suất không đổi. Thí dụ: phản ứng được thực hiện trong
bình cầu ăn thông với khí quyển bên ngoài. - Biến đổi đẳng nhiệt: là biến đổi được
thực hiện trong điều kiện nhiệt độ không đổi. Thí dụ: phản ứng được thực hiện trong một
bình cầu nhỏ được đặt trong bình điều nhiệt(*) giữ ở nhiệt độ xác
định. - Biến đổi đoạn nhiệt: là biến đổi được
thực hiện trong điều kiện không có sự trao đổi nhiệt lượng giữa hệ
với môi trường ngoài. Thí dụ: phản ứng được thực hiện trong
bình Dewar đậy kín, được bao quanh bởi các lớp cách nhiệt thật dày. Một đại lượng được gọi là hàm số trạng
thái của hệ nếu biến thiên của đại lượng đó chỉ phụ thuộc vào trạng
thái đầu và trạng thái cuối của hệ mà không phụ thuộc vào cách tiến
hành quá trình (như thuận nghịch hay bất thuận nghịch). Nói chung, tất cả các biến số trạng thái
của hệ như nhiệt độ T, áp suất p, thể tích V.... đều là những hàm số
trạng thái của hệ vì những biến số đó chỉ đặc trưng cho trạng thái
đang xét của hệ. Khi hệ chuyển từ trạng thái đầu sang trạng thái
cuối, biến thiên của những biến số trạng thái của hệ chỉ phụ thuộc
vào những trạng thái đó, không phụ thuộc vào các trạng thái trung
gian mà hệ trải qua. Một biến thiên hữu hạn (tương đối lớn)
của một biến số trạng thái x trong quá trình được ghi là Một biến thiên vô cùng nhỏ của biến số
trạng thái x sẽ được ghi là dx hoặc dx
Có những đại lượng không phải là hàm số
trạng thái của hệ trong trường hợp tổng quát như nhiệt lượng q, công
W. Nhiệt lượng q và công W mà hệ trao đổi với môi trường ngoài không
những phụ thuộc vào trạng thái đầu, trạng thái cuối của hệ mà còn
phụ thuộc vào cách tiến hành quá trình. Chúng đặc trưng cho quá
trình chứ không phải là biến số trạng thái của hệ. Chúng ta qui ước
dùng ký hiệu d để chỉ những lượng vô cùng
nhỏ của những đại lượng nào không phải là hàm số trạng thái của hệ,
thí dụ: dq, dW
và dùng ký hiệu d hoặc d cho những biến
thiên vô cùng nhỏ của những biến số là hàm số trạng thái của hệ, thí
dụ: dT, dp, dV,... Trong sự tương tác giữa hệ với môi trường
ngoài có thể có xảy ra sự trao đổi năng lượng. Khi đó có hai cách
khác nhau trong sự chuyển năng lượng từ vật này sang vật khác. Nếu
sự chuyển năng lượng có liên quan đến sự thay đổi cường độ chuyển
động phân tử của hệ thì sự chuyển năng lượng này được thực hiện dưới
dạng nhiệt. Nếu sự chuyển năng lượng có liên quan đến sự chuyển dịch
những khối lượng vật chất vĩ mô dưới tác dụng của những lực nào đó
thì sự chuyển năng lượng này được thực hiện dưới dạng công. Thí dụ: đốt nóng một hệ khí chứa trong
một xy lanh kín thì các phân tử khí sẽ gia tăng
chuyển động: hệ đã nhận năng lượng dưới dạng nhiệt. Khí giãn nở đẩy
piston (có khối lượng) đi lên một đoạn: hệ đã cung cấp ra môi trường
ngoài năng lượng dưới dạng công. Còn nếu dùng lực nén piston đi
xuống một đoạn: hệ đã nhận năng lượng từ môi trường ngoài dưới dạng
công; các phân tử khí chuyển động hạn chế trong một thể tích nhỏ hơn
nên có sự va chạm giữa các phân tử khí nhiều hơn và kết quả là hệ
nóng lên: hệ đã cung cấp năng lượng cho môi trường ngoài dưới dạng
nhiệt. Theo qui ước về dấu của nhiệt động học: - Nếu hệ tỏa nhiệt thì nhiệt có trị số
âm, q < 0. - Nếu hệ thu nhiệt thì nhiệt có trị số
dương, q > 0. - Nếu hệ tạo công thì công có trị số âm,
W < 0. - Nếu hệ nhận công thì công có trị số
dương, W > 0.
Chú ý: Qui ước dấu của công W trước
đây cũng như còn trong một số sách hiện nay trái với
qui ước trên, nghĩa là công W mà hệ nhận thì âm còn công W mà hệ tạo
thì dương. Khuynh hướng hiện nay người ta cho rằng nhiệt q và công W
đều có thứ nguyên năng lượng (cal hay Joule) nên qui ước dấu giống
nhau; Qui ước dấu về nhiệt q ở đây cũng trái với sách giáo khoa môn
hóa học trong phổ thông. Ở phổ thông, với phản ứng tỏa nhiệt thì
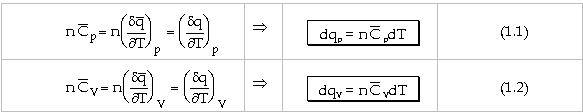
nhiệt phản ứng dương, với phản ứng thu nhiệt thì nhiệt phản ứng âm. a. Nhiệt Nhiệt lượng q cần dùng để đem m gam hóa
chất tăng lên một khoảng nhiệt độ tương đối nhỏ từ T1 đến T2 là: q = mc(T2 - T1) Với c là tỉ nhiệt (nhiệt dung riêng) của
hóa chất, đó là lượng nhiệt cần để đem một gam hóa chất tăng lên một
độ, được xem như không đổi trong khoảng nhiệt độ trên. Thường người ta đo nhiệt lượng q ở áp
suất không đổi hoặc ở thể tích không đổi, lúc đó tỉ nhiệt c sẽ là tỉ
nhiệt đẳng áp Nếu m = M, phân tử gam (khối lượng mol
phân tử tính bằng gam), thì có tỉ nhiệt mol đẳng áp Mcp = Trên thực tế, thường
Ứng với một mol hóa chất, ta có:
=> Trị số tỉ nhiệt mol đẳng áp
Với n mol hóa chất:
b. Công Ta thiết lập biểu thức tính công giãn ép
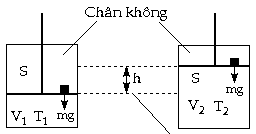
của hệ. - Trường hợp áp suất ngoài không đổi:
Xem một hệ chứa khí giãn nở như hình vẽ trên từ thể tích V1 đến thể tích V2. Giả sử piston có khối lượng không đáng kể và hệ chỉ chịu tác dụng của áp suất ngoài không đổi tạo nên bởi sự đè lên của trọng lượng mg, với m là khối lượng của một vật nhỏ được đặt trên bề mặt piston, g là gia tốc trọng trường, S là tiết diện của piston. Áp suất ngoài là:
Ghi chú: Áp suất là áp lực tác dụng
lên một đơn vị diện tích. Lực ép thẳng góc với diện
tích mặt bị ép được gọi là áp lực. Công giãn nở của khí khi piston di chuyển
lên một đoạn h là: W = - mgh (Công = lực x đoạn đường. Thêm dấu - để công tạo có trị số âm)
V2 - V1: độ tăng thể tích ứng với sự di
chuyển của piston lên một đoạn h. Nếu V2 - V1 > 0 => W < 0: hệ tạo công Nếu V2 - V1 < 0 => W > 0: hệ nhận công
(để nén piston đi xuống) W < 0: công giãn nở của hệ để chống áp
suất ngoài. W > 0: công ép, hệ nhận công bởi áp suất
ngoài đè lên. Nếu - Trường hợp áp suất ngoài thay đổi theo
thể tích V: Trong trường hợp này ta xem một đoạn di
chuyển nhỏ dh ứng với một độ tăng thể tích nhỏ dV trong đó áp suất
ngoài Công
[Dùng ký hiệu (W vì công W không phải là
một hàm số trạng thái, nó thay đổi tùy theo đường biến đổi] Nếu hệ chứa khí lý tưởng và biến đổi đẳng nhiệt, thuận nghịch, ta có:
Ngoài ra người ta cũng chứng minh được
rằng công giãn nở thuận nghịch là công cực đại (về trị số tuyệt đối)
còn công cần cung cấp để nén ép hệ một cách thuận nghịch là công cực
tiểu (về trị số tuyệt đối). Nghĩa là cùng trạng thái đầu, trạng thái
cuối như nhau, nếu hệ giãn nở thuận nghịch thì công tạo có trị số âm
hơn so với công giãn nở bất thuận nghịch. Nếu hệ bị nén ép thuận nghịch thì công
cần cung cấp ít dương hơn so với biến đổi nén ép bất thuận nghịch. Do đó xét theo dấu đại số thì
II. NGUYÊN LÝ THỨ NHẤT NHIỆT ÐỘNG HỌC. NỘI NĂNG U (E) VÀ ENTALPI H
Nguyên lý thứ nhất nhiệt động học được
phát biểu như sau:
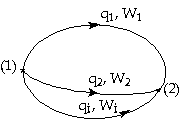
Về phương tiện toán học, biểu thức trên chỉ rằng ta có thể tìm được một hàm số năng lượng U của hệ nghiệm đúng điều kiện:
[Lưu ý là nếu qui ước dấu của công W
ngược với giáo trình này (như ở trong hầu hết các giáo trình hóa lý
trước đây), nghĩa là công W mà hệ nhận thì có trị số âm, còn công W
mà hệ tạo thì có trị số dương, thì biểu thức của nguyên lý thứ nhất
sẽ là: U2 và U1 lần lượt là trị số của U ở trạng
thái cuối và trạng thái đầu của hệ. q và W là nhiệt và công trao đổi giữa hệ
với môi trường ngoài theo bất cứ đường biến đổi nào để hệ đi từ
trạng thái đầu đến trạng thái cuối. Hàm số U này biểu diễn nội năng của hệ
tức năng lượng sẵn chứa trong hệ. [Nội năng của hệ do: - Ðộng năng chuyển động phân tử: tịnh
tiến, quay, dao động. - Năng lượng tương tác giữa các phân tử:
hút, đẩy. - Năng lượng các điện tử trong phân tử. - Năng lượng dự trữ của hạt nhân nguyên
tử...] Ứng với một biến đổi nhỏ, ta có:
|