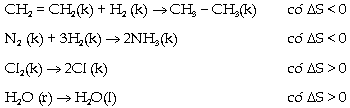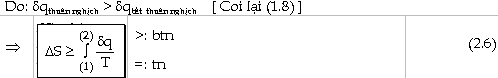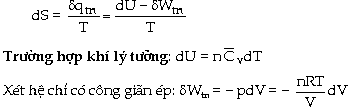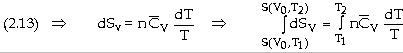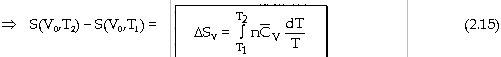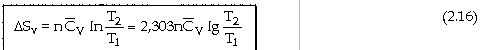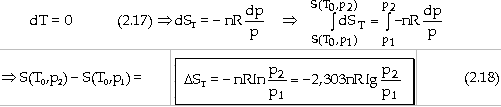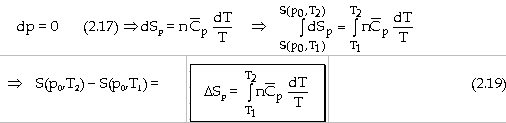NGUYÊN
LƯ THỨ HAI NHIỆT ĐỘNG HỌC
|
|
Nguyên
lư thứ nhất nhiệt động học giúp
xác định biến đổi nội năng Xem
một hệ gồm các phân tử một
chất khí đang ở nhiệt độ
thấp, nếu ta đốt nóng hệ tức
cung cấp một nhiệt lượng q vào, các
phân tử khí sẽ gia tăng chuyển động,
có sự xáo trộn hay mất trật tự
nhiều trong hệ so với trước khi cung
cấp q. Nhiệt lượng q càng nhiều th́
sự xáo trộn càng lớn, tức sự
biến thiên xáo trộn tỉ lệ thuận
với nhiệt lượng q được cung
cấp vào hệ. Nếu
cùng một lượng nhiệt q nhưng nếu
cung cấp vào hệ trên đang ở nhiệt
độ cao, th́ sự biến thiên xáo trộn
sẽ ít hơn so với lúc hệ đang ở
nhiệt độ thấp. Như
vậy sự biến thiên xáo trộn tỉ
lệ nghịch với nhiệt độ T. Người ta dùng một hàm số trạng thái để đo mức độ xáo trộn hay độ tự do của một hệ. Đó là hàm số entropi S mà trong một biến đổi nhỏ được cho bởi:
Ở nhiệt độ không đổi, với một biến đổi thuận nghịch xác định:
Khi nhiệt độ T thay đổi:
V́
là hàm số trạng thái, giống như hàm
số nội năng U, hàm số entalpi H, nên
biến đổi entropi không tùy thuộc
đường biến đổi mà chỉ tùy
thuộc trạng thái đầu và trạng thái
cuối của hệ mà thôi.
Trong
phạm vi hóa học, hàm số entropi được
dùng với ư nghĩa để ước định
độ tự do của một hệ hóa
học. Một
hệ biến đổi từ trạng thái đầu
đến trạng thái cuối, với trạng
thái cuối ít tự do hơn trạng thái đầu
th́ Ngược
lại, nếu trạng thái cuối tự do hơn
trạng thái đầu th́ Thí
dụ:
Nguyên
lư thứ hai nhiệt động học có
thể được phát biểu như sau: - Mỗi hệ được xác định bằng một đại lượng gọi là entropi S mà biến đổi dS trong một biến đổi nhỏ là:
Với
một biến đổi xác định từ
trạng thái (1) đến trạng thái (2),
biến đổi entropi
Trong
một biến đổi đẳng nhiệt,
thuận nghịch, biến đổi entropi
-
Trong một biến đổi thuận nghịch: *
Nếu hệ cô lập, th́ biến đổi
entropi
* Nếu hệ không cô lập th́ hệ cộng môi trường ngoài tạo thành một hệ cô lập, nên tổng số biến đổi entropi của hệ và của môi trường ngoài bằng không.
-
Trong một biến đổi tự nhiên (bất
thuận nghịch): * Nếu hệ cô lập, th́ biến đổi entropi của hệ dương:
* Nếu hệ không cô lập th́ tổng số biến đổi entropi của hệ và của môi trường ngoài dương.
III.
CÁCH TÍNH BIẾN ĐỔI ENTROPI Hàm
số entropi S phụ thuộc vào các biến
số nhiệt độ T, thể tích V hay áp
suất p. S =
S(T,V) hay S = S(T,p)
- Với biến đổi đẳng nhiệt ở To: (dT = 0)
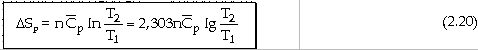
- Với biến đổi đẳng tích ở thể tích không đổi V0: (dV = 0)
Nếu
tỉ nhiệt mol đẳng tích
dS
= [Coi
như chỉ có công giăn ép] dS
= Với
trường hợp khí lư tưởng:
- Với biến đổi đẳng nhiệt ở T0:
- Với biến đổi đẳng áp ở p0:
Nếu
tỉ nhiệt mol đẳng áp
|