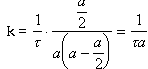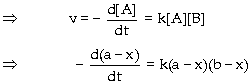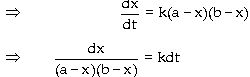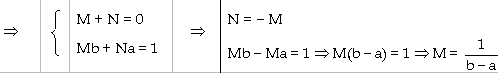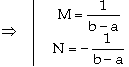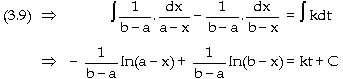|
|
|
Ðộng hóa học có mục
đích khảo sát vận tốc phản ứng,
tức xem một phản ứng hóa học
xảy ra nhanh hay chậm. Có những phản
ứng xảy ra rất nhanh như phản ứng
trung hòa giữa acid mạnh với baz mạnh,
phản ứng nổ của thuốc súng... cũng
có những phản ứng xảy ra rất
chậm như phản ứng ester- hóa giữa acid
hữu cơ với rượu, sự tạo
rỉ sét (gỉ sắt, rỉ sắt, sét)... Về mặt công nghiệp,
một phản ứng hóa học chỉ có
lợi thật sự nếu hiệu suất
phản ứng đạt được cao trong
một thời gian càng ngắn càng tốt. Còn
những phản ứng có hại như sự
ăn mòn kim loại, sự tạo khí làm ô
nhiễm môi trường... chúng ta cần hạn
chế vận tốc của chúng. Cũng có nhiều phản
ứng tuy nhiệt động học cho phép
xảy ra Do đó, vấn đề
khảo sát vận tốc phản ứng rất
cần thiết trong phạm vi hóa học ứng
dụng. Về mặt khoa học cơ
bản, động hóa học đóng vai trò quan
trọng trong việc tìm hiểu diễn tiến
của phản ứng hóa học tức xác định
cơ chế phản ứng hóa học. Phản ứng đơn
giản hay còn gọi là phản ứng sơ
cấp là phản ứng một chiều chỉ
xảy ra trong một giai đoạn duy nhất,
nghĩa là phản ứng đi trực tiếp
từ tác chất tạo sản phẩm mà không có
tạo các chất trung gian. Những phản
ứng không thỏa mãn điều kiện trên
được gọi là phản ứng phức
tạp. Phản ứng song song, phản ứng
nối tiếp... là các phản ứng phức
tạp. Thí dụ: - Phản ứng - Phản ứng: N2O5 -> N2O3
+ O2 N2O3 + N2O5
-> 4NO2 - Phản ứng đồng
thể: là phản ứng chỉ xảy ra trong
thể tích một pha. Phản ứng đồng
thể chỉ có thể xảy ra trong pha khí
hoặc pha lỏng mà không xảy ra trong pha
rắn vì khi một chất rắn đồng
thể tham gia phản ứng hóa học thì nó
trở thành dị thể. - Phản ứng dị
thể: là phản ứng chỉ xảy ra trên
bề mặt phân chia hai pha, không xảy ra trong
thể tích của một pha nào. Thí dụ: Phản ứng
oxid-hóa khí SO2 bởi khí O2 tạo thành khí SO3
xảy ra trên bề mặt chất xúc
tác rắn Pt (hay V2O5) là một phản ứng
dị thể. - Phản ứng đồng
pha: là phản ứng trong đó hệ hóa học
chỉ làm thành một pha từ đầu đến
cuối. - Phản ứng dị pha: là
phản ứng trong đó hệ hóa học làm thành
hai hay nhiều pha khác nhau: Thí dụ:
Vận tốc phản ứng
là đại lượng cho biết sự nhanh
hay chậm của phản ứng. Vận tốc
phản ứng được xác định
bằng cách đo độ giảm số mol
của tác chất hay độ tăng số mol
của sản phẩm trong một đơn
vị thời gian. Ðối với phản ứng
đồng thể trong pha khí hay trong dung dịch có
thể tích không đổi thì vận tốc
phản ứng thường được xác
định bằng cách đo độ giảm
nồng độ (mol/lít) của tác chất hay
độ tăng nồng độ sản
phẩm trong một đơn vị thời gian. Xem phản ứng đồng
thể đồng pha: A + B -> C + D Ở thời điểm t,
giả sử nồng độ (mol/l) của A, B,
C, D lần lượt là [A], [B], [C], [D]. Ở
thời điểm
Theo định nghĩa trên,
vận tốc trung bình của phản ứng là:
( Dấu - được thêm
vào để vận tốc có trị số dương
) Vận tốc phản ứng
thay đổi theo thời gian t. Vận tốc tức thời
ở thời điểm t là:
(Vận tốc phản ứng
bằng trừ đạo hàm của hàm số
nồng độ tác chất theo biến số
thời gian hay bằng đạo hàm của hàm
số nồng độ sản phẩm theo
thời gian). Tổng quát với phản
ứng: mA + nB -> pC + qD Thì vận tốc của
phản ứng là:
(Chia cho các hệ số tỉ
lượng tương ứng để vận
tốc phản ứng tính theo bất cứ
chất nào của phản ứng cũng bằng
nhau). Với phản ứng đồng
thể: A + B -> sản phẩm. Thực nghiệm cho biết
vận tốc phản ứng là:
Với [A], [B] lần lượt
là nồng độ mol/l của các tác chất A,
B. Người ta nói: - Phản ứng có bậc
tổng quát (hay bậc toàn phần) là m + n. - Phản ứng có bậc m
theo A, bậc n theo B. (Hay có bậc riêng phần m
theo A, bậc riêng phần n theo B) k là một hằng số không
phụ thuộc vào nồng độ các chất
trong phản ứng, nó chỉ phụ thuộc vào
loại phản ứng và nhiệt độ
thực hiện phản ứng (k tỉ lệ
với nhiệt độ T: m, n là các trị số
được xác định từ thực
nghiệm, có thể là số nguyên 1, 2, 3 hoặc
là phân số hoặc bằng 0, đôi khi có
thể là số âm. Bậc tổng quát của
phản ứng có thể là số nguyên (1, 2, 3...)
hay là một số lẻ ( Trong thực tế hầu như
không gặp những phản ứng có bậc cao
hơn 3. Với các phản ứng
đơn giản thì bậc phản ứng thường
bằng hệ số tỉ lượng nguyên
tối giản đứng trước các
chất trong phản ứng. Thí dụ:
=> phản ứng có bậc
2 tổng quát, bậc 1 theo H2, bậc 1 theo I2. - Với phản ứng Thực nghiệm cho biết => Phản ứng này
thuộc bậc 2 tổng quát, bậc 1 theo - Với phản ứng
thủy phân clorur tert-butil trong lượng nước
có dư: (CH3)3C-Cl + H2O
-> (CH3)3C-OH + HCl Thực nghiệm cho biết => phản ứng này có
bậc 1 tổng quát, bậc 1 theo ( Do nước lấy dư khá
nhiều so với - Với phản ứng
cộng brom vào alken (olefin):
Thực nghiệm cho biết => phản ứng có bậc
3 tổng quát, bậc 1 theo - Với phản ứng => phản ứng có bậc
3/2 tổng quát, bậc 1 theo H2, bậc 1/2 theo Br2
(ở giai đoạn đầu) (Khi có tạo HBr
khá nhiều, vận tốc phản ứng còn
phụ thuộc vào nồng độ sản
phẩm HBr). - Với phản ứng Thực nghiệm cho biết => Phản ứng có bậc
3 tổng quát, bậc 2 theo NO, bậc 1 theo O2. - Với phản ứng
tạo phosgen: CO(k) + Cl2(k) -> COCl2(k) Thực nghiệm cho biết => Phản ứng có bậc Cần lưu ý bậc
phản ứng là một khái niệm thực
nghiệm.
Phản ứng hóa học
xảy ra luôn luôn kèm theo sự đứt liên
kết và ráp liên kết (đứt nối và ráp
nối). Sự đứt liên kết và ráp liên
kết có thể xảy ra đồng thời
hoặc không đồng thời. Giả sử
phản ứng xảy ra giữa A và B thì hai phân
tử A và B phải va chạm vào nhau và phải có
năng lượng thích hợp để tạo
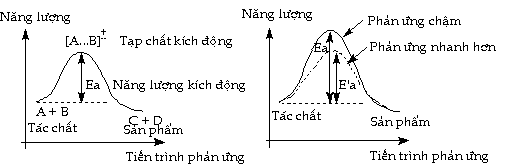
phản ứng hóa học. Năng lượng
tối thiểu mà hóa chất cần phải có
thêm so với trạng thái ban đầu để
tạo phản ứng hóa học được
gọi là năng lượng hoạt hóa (năng
lượng kích động). Trạng thái của
hóa chất ứng với năng lượng
cao nhất được gọi là trạng thái
chuyển tiếp. "Hợp chất" tương
ứng với trạng thái này được
gọi là phức hoạt hóa (hay tạp chất kích
động hay hợp chất phức tạp kích
động). Tạp chất kích động
có liên kết thường không được xác
định. Năng lượng hoạt hóa
(kích động) càng cao thì phản ứng
xảy ra càng chậm, hằng số vận
tốc k càng nhỏ. Phân tử số của
phản ứng được định nghĩa
là số phân tử của hóa chất cần
thiết để tạo phân tử
tạp chất kích động này. Như vậy,
để biết phân tử số cần
phải biết cơ chế của phản
ứng.
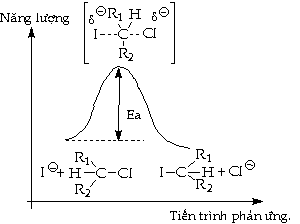
Thí dụ: Phản
ứng:
Theo cơ chế:
Tạp chất kích
động (Sự đứt
liên kết và ráp liên kết xảy ra cùng lúc, phân
tử số 2)
Phản ứng thế trên
xảy ra trong một giai đoạn duy nhất.
Tạp chất kích động ở vị trí
đỉnh của giản đồ biến đổi
năng lượng theo tiến trình phản
ứng. Tạp chất kích động không cô
lập được (vì có năng lượng
cao, không bền, hiện diện trong thời gian
rất ngắn). Một phản ứng hóa
học có thể xảy ra theo nhiều giai đoạn.
Trong trường hợp này, sản phẩm
của giai đoạn trước là tác chất
của giai đoạn sau và được
gọi là chất trung gian. A + B -> C -> D
Trong giản đồ trên, C là
chất trung gian. Tùy theo C có năng lượng
thấp hay cao, C có thể cô lập được
hay không. Vị trí của C là trũng của
giản đồ toàn vẹn. Có trường
hợp phản ứng gồm nhiều giai đoạn
mà một trong những giai đoạn xảy ra
thật chậm tương ứng với năng
lượng kích động cao nhất. Giai đoạn
chậm nhất ấy là giai đoạn xác
định vận tốc phản ứng (giai
đoạn tốc định), bởi vì phản
ứng đã vượt qua giai đoạn
chậm này thì các giai đoạn còn lại
phản ứng vượt qua dễ dàng. Về phương
diện động hóa học, chính giai đoạn
chậm này là giai đoạn quan trọng nhất
trong việc đề nghị cơ chế cho
một phản ứng hóa học và bậc
tổng quát của phản ứng căn cứ vào
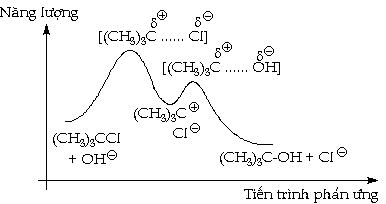
giai đoạn chậm nhất này. Thí dụ: Với phản
ứng: Phản ứng này trải qua
hai giai đoạn: - Giai đoạn đầu:
chậm, tạo ra chất trung gian carbonium:
- Giai đoạn sau: nhanh, là
phản ứng của carbonium với OH( để
tạo sản phẩm cuối cùng:
Trong giản đồ biến
đổi năng lượng theo tiến trình
phản ứng của sự thủy phân clorur
tert-butil trong dung dịch baz loãng, ta có hai tạp
chất kích động và một chất trung
gian. Phân biệt chất trung gian và
tạp chất kích động: - Chất trung gian là chất có
thực, có thể nhận biết được
và trong một số trường hợp có
thể cô lập được nếu bền. Tạp chất kích động
không cô lập được và có thể
chỉ là một hợp chất lý thuyết. - Chất trung gian nằm ở
trũng của giản đồ, trong khi tạp
chất kích động nằm ở đỉnh
của giản đồ biến đổi năng
lượng theo tiến trình phản ứng. II. PHƯƠNG
TRÌNH ÐỘNG HỌC CỦA MỘT SỐ PHẢN
ỨNG CÓ BẬC Phương trình động
học của một phản ứng là biểu
thức liên hệ giữa nồng đồ tác
chất, hằng số vận tốc phản
ứng, nồng độ lúc đầu của tác
chất và thời gian thực hiện phản
ứng. Xem phản ứng đồng
thể : A -> C + D t = 0 : a(mol/l) 0 0 t : x mol phản ứng x x
[A] = a - x : nồng độ
ở thời điểm t của tác chất A. Vì là phản ứng bậc
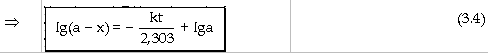
nhất:
Ðây là phương trình động
học của phản ứng bậc nhất, cho
biết sự phụ thuộc của nồng
độ tác chất theo thời gian t, hằng
số vận tốc k của phản ứng và
nồng độ ban đầu của tác
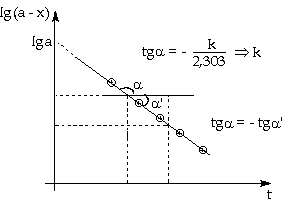
chất. Muốn xác định
hằng số vận tốc phản ứng k, ta
đo nồng độ tác chất (a - x) ở các
thời điểm t khác nhau, rồi vẽ
đường biểu diễn các hàm số lg(a
- x) theo thời gian t, sẽ có một đường
thẳng mà hệ số góc (độ dốc) là
Ghi chú: - Sở dĩ phải làm
nhiều thí nghiệm ở các thời điểm
t khác nhau, đo nồng độ tác chất
ở các thời điểm tương ứng và
vẽ đường biểu diễn lg(a - x) theo
t để xác định k, vì đây là môn
thực nghiệm nếu chỉ đo một
lần, mà lần này làm sai thì kết quả
sẽ sai. Ta đo nhiều lần, vị trí nào
lệch quá nhiều so với đường
thẳng mà các thí nghiệm khác đi qua thì có
thể thí nghiệm đó đo sai, ta có thể
bỏ qua thí nghiệm này. - Nếu đo được
khá đúng trong một lần thí nghiệm thì có
thể áp dụng công thức để tính
trực tiếp hằng số vận tốc k. Từ
- Từ Bán sinh phản ứng (bán
hủy phản ứng, thời gian nửa phản
ứng) là thời gian Từ Khi
Như vậy, trong một
phản ứng bậc nhất, bán sinh của
phản ứng tỉ lệ nghịch với
hằng số vận tốc k và không phụ
thuộc vào nồng độ tác chất ban đầu. Thí dụ: các phản ứng
bậc nhất như phản ứng thế SN1,
phản ứng khử E1. Xem phản ứng đồng
thể: A + B -> C + D a. Trường hợp nồng
độ hai tác chất lúc đầu bằng
nhau A + B -> C + D 1 lít hệ phản ứng, t =
0 : a mol a 0 0 t : x mol phản ứng x => x
=> x => còn : (a - x) (a - x)
Ðây là phương trình động
học của phương trình phản ứng
bậc 2 trong đó nồng độ ban đầu
hai tác chất bằng nhau, đều bằng a
(mol/l), nồng độ hai tác chất ở
thời điểm t là (a - x) mol/l. Muốn xác định
hằng số vận tốc phản ứng k, ta
đo nồng độ tác chất (a ( x) ở các
thời điểm t khác nhau rồi vẽ
đường biểu diễn của hàm sốĠ
theo t, sẽ được một đường
thẳng mà hệ số góc (độ dốc) là
k, tung độ gốc làĠ. Từ đó xác
định được k.
Từ
Như vậy, hằng số
vận tốc phản ứng k của phản
ứng bậc 2 có đơn vị là Bán sinh phản ứng: Khi (3.7) =>
Vậy với phản ứng
bậc nhì, nồng độ hai tác chất ban
đầu bằng nhau thì bán sinh phản ứng
tỉ nghịch với hằng số vận
tốc k và nồng độ ban đầu a
của tác chất. b. Trường hợp nồng độ
hai tác chất lúc đầu khác nhau A + B -> C + D 1 lít hệ phản ứng, t =
0 : a (mol/l) b mol 0 0 t : x mol phản ứng x => x
=> x => còn : a - x b - x
Đặt |
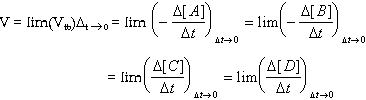
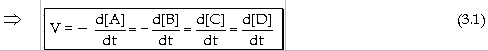

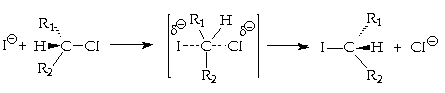






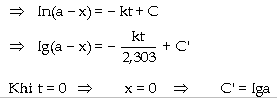

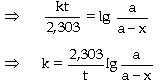
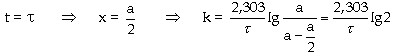

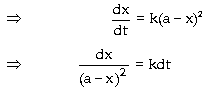

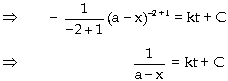

 (3.7)
(3.7)