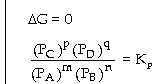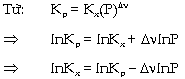|
|
|
Phản
ứng Thí
dụ: Với phản ứng ester hóa giữa acid
acetic CH3-COOH
+ CH3-CH2-OH Nếu
lấy 1mol Phản
ứng cân bằng Cân
bằng hóa học được gọi là cân
bằng động v́ thực ra luôn luôn có
phản ứng thuận và nghịch xảy ra nhưng
do lượng các chất trong hệ phản
ứng không thay đổi khi phản ứng đạt
trạng thái cân bằng nên phản ứng
được coi như xong. Hơn nữa, có
thể làm thay đổi trạng thái cân bằng
của phản ứng bằng cách thay đổi
các yếu tố như nồng độ các
chất, nhiệt độ, áp suất. I.
ĐỊNH LUẬT TÁC DỤNG KHỐI LƯỢNG Định
luật này do Gulberg, Waage (Na Uy) đưa ra năm
1864, nhằm xác định trạng thái cân
bằng của một phản ứng cân bằng.
a.
Hằng số cân bằng Kc Xét
phản ứng cân bằng:
Gọi
Vận
tốc phản ứng thuận là: v1
= k1[A][B] Vận
tốc phản ứng nghịch là: v-1
= k - 1[C][D] Giả
sử lúc bắt đầu phản ứng,
chỉ có A, B hiện diện. Vận tốc
phản ứng thuận Như
vậy, v1
= v- 1 =>
k1[A][B] = k_ 1[C][D] =>
V́
cb:
cân bằng, chỉ nồng độ các chất
C, D, A, B lúc đạt trạng thái cân bằng. Kc
được gọi là hằng số cân
bằng của phản ứng liên hệ đến
nồng độ (mol/l). Kc chỉ phụ thuộc
nhiệt độ và bản chất của
phản ứng, mà không phụ thuộc vào
nồng độ các chất trong
phản ứng. Hệ
thức trên biểu diễn sự liên hệ
giữa nồng độ hóa chất (tức
khối lượng của hóa chất) lúc cân
bằng, chính là nội dung của định
luật tác dụng khối lượng. Có
thể phát biểu định luật này như
sau: Khi một phản ứng đồng thể
đạt trạng thái cân bằng th́ tỉ
số tích số nồng độ sản
phẩm với tích số nồng độ tác
chất là một hằng số ở một
nhiệt độ xác định. Tổng
quát với phản ứng: mA
+ nB người ta chỉ rằng:
Với
[A], [B], [C], [D] là nồng độ của A, B, C, D
lúc cân bằng. Thí
dụ: với phản ứng: 2NOCl(k)
th́
b.
Hằng số cân bằng Kp Hằng
số cân bằng này liên hệ đến áp
suất riêng phần của hóa chất ở
thể khí lúc cân bằng (lúc đạt trạng
thái cân bằng). [
Áp suất riêng phần của mỗi cấu
tử của hỗn hợp có thể tích chung là
V là áp suất mà cấu tử ấy có khi nó
đứng riêng một ḿnh và cũng chiếm
thể tích V của hỗn hợp ở cùng
nhiệt độ ]. Xét
phản ứng: Gọi
PA, PB, PC, PD lần lượt là áp suất riêng
phần của các khí A, B, C, D có thể xem như
khí lư tưởng lúc cân bằng Từ
Thay
[A], [B], [C], [D] vào biểu thức của hằng
số cân bằng KC:
Do
KC chỉ phụ thuộc nhiệt độ c.
Hằng số cân bằng Kx Hằng
số cân bằng này liên hệ đến phân
số mol (phân mol, phần mol) của các chất
trong phản ứng. [
Phân số mol (phân mol hay phần mol) x của
cấu tử i trong hỗn hợp gồm nhiều
cấu tử là tỉ số giữa số mol
của i với tổng số mol của các
cấu tử có trong hỗn hợp.
Xét
phản ứng: Gọi
P là áp suất của hỗn hợp khí lúc cân
bằng;
Với
Thế
Như
vậy hằng số cân bằng Kx phụ
thuộc vào nhiệt độ T và áp suất
tổng quát P của hỗn hợp khí lúc cân
bằng. Nếu
=>
p + q = m + n =>
Tổng hệ số mol khí bên sản phẩm =
Tổng hệ số mol khí bên tác chất
Chú
thích: -
Người ta chỉ rằng trong biểu thức
của các hằng số cân bằng liên hệ
đến khí nêu trên, ta không chú ư đến các
chất lỏng và chất rắn. Thí
dụ: CaCO3(r)
Kp
= PCO2 NH4Cl(r)
Kp
= PHCl.PNH3 HCl(k)
+ NH3(k) Kp
= -
Hằng số cân bằng K càng lớn, phản
ứng càng thiên về chiều thuận, hằng
số cân bằng K càng nhỏ phản ứng càng
thiên về chiều nghịch - Tùy
theo hệ số của phản ứng mà hằng
số cân bằng của cùng một phản
ứng có thể khác nhau. Thí
dụ: với phản ứng
Với
phản ứng
Trong
trường hợp này, thường hằng
số cân bằng Với
phản ứng: mA(dd)
+ nB(dd) Người
ta cũng chỉ rằng:
Với
[C], [D], [A], [B] lần lượt là nồng độ
của C, D, A, B trong dung dịch lúc phản ứng
đạt trạng thái cân bằng. Trong
trường hợp dung dịch lỏng nếu
trong hệ phản ứng có hiện diện
chất rắn th́ ta không chú ư đến
chất rắn. Thí
dụ:
Với
Xem
phản ứng cân bằng của các hóa chất
ở thể khí: mA(k)
+ nB(k) Biến
đổi năng lượng tự do (G của
phản ứng là:
Với
khí có thể xem như khí lư tưởng, ở
điều kiện đẳng nhiệt, sự
phụ thuộc của hàm số năng lượng
tự do G theo áp suất P là:
Trong
đó
Khi
phản ứng đạt trạng thái cân
bằng ở áp suất P, nhiệt độ T th́:
Hệ
thức trên cho biết có thể tính được
hằng số cân bằng dựa vào các đại
lượng nhiệt động học của hóa
chất. Theo
trên: -
Nếu Do
đó, với những phản ứng cân bằng
tương ứng với -
Nếu Vậy
những phản ứng cân bằng ứng với
Với
trường hợp dung dịch lỏng và loăng
với phản ứng: mA(dd)
+ nB(dd) Ở
trạng thái chuẩn thức thích hợp, người
ta cũng chứng minh được hệ
thức:
Lúc
phản ứng đạt trạng thái cân
bằng, ta có:
II.
ĐỊNH LUẬT DỜI ĐỔI MỨC CÂN
BẰNG LE CHÂTELIER "Trong
một phản ứng cân bằng, sự thay đổi
một yếu tố làm xáo trộn mức cân
bằng sẽ làm cân bằng dời đổi
theo chiều chống lại sự thay đổi
ấy". Chúng
ta sẽ xét một số yếu tố có thể
làm thay đổi mức cân bằng: Sự
thay đổi nồng độ của một
chất sẽ làm cân bằng dời đổi
theo chiều chống lại sự thay đổi
ấy. Nghĩa là nếu làm tăng nồng độ
một chất th́ cân bằng sẽ dịch
chuyển theo chiều làm giảm nồng độ
của chất này xuống, tức là chiều
chất này tham gia phản ứng; c̣n nếu làm
giảm nồng độ của một chất
(như lấy bớt chất này ra khỏi hệ
phản ứng) th́ cân bằng sẽ dịch
chuyển theo chiều làm tăng nồng độ
chất này lên, tức là chiều phản ứng
tạo ra thêm chất này. Xem
phản ứng cân bằng: A +
B Khi
phản ứng đạt trạng thái cân
bằng, ta có:
Nếu
lúc bấy giờ, thêm chất A vào hệ
phản ứng th́
Tương
tự, sau khi phản ứng đạt được
trạng thái cân bằng, bây giờ nếu ta
lấy bớt C hoặc D ra khỏi môi trường
phản ứng, th́ cân bằng sẽ bị phá
vỡ và cân bằng mới sẽ được
thiết lập theo hướng tạo ra thêm C, D. Nói
chung muốn phản ứng cân bằng: A +
B Cho
ra nhiều sản phẩm C, D th́ người ta có
thể: - Làm
tăng nồng độ tác chất A, B. -
Hay làm giảm nồng độ sản phẩm C,
D. Trong
một phản ứng cân bằng có liên hệ
đến khí, khi làm tăng áp suất th́
mức cân bằng sẽ dời đổi theo
chiều chống lại sự tăng áp suất,
tức là chiều làm giảm số mol khí, c̣n
khi làm giảm áp suất th́ mức cân bằng
sẽ dời đổi theo chiều làm tăng áp
suất lên, tức là chiều tạo ra nhiều
số mol khí hơn.
Với
*
Nếu
|




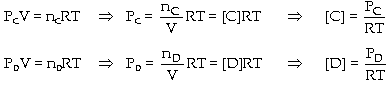
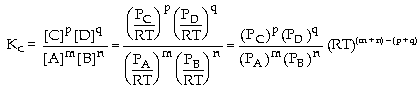


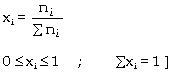
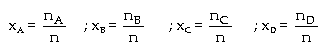
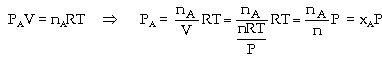
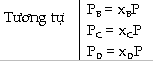

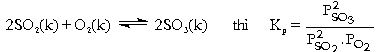
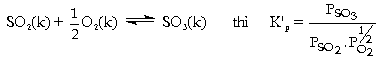


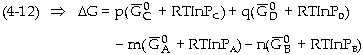
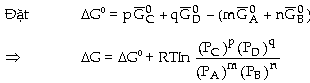 (4-13)
(4-13)