Ngày nay dung dịch không
phải là một khái niệm xa lạ nhờ tính
phổ biến của nó. Tuy nhiên để
hiểu đúng về dung dịch không phải là
chuyện đơn giản. Với các lý
thuyết hiện đại về hóa học
đến nay vẫn chưa giải thích
được rõ ràng một số vấn đề
về dung dịch như: tính tan của các
chất trong dung môi, các tính chất của dung
dịch có nồng độ chất tan lớn,...
Do đó vấn dề tìm hiểu dung dịch không
chỉ xuất phát từ yêu cầu về
mặt thực tiễn mà còn do yêu cầu về
mặt lý thuyết.
a). Các hệ phân tán và dung
dịch
Dung dịch là các hệ phân tán
nhưng không phải hệ phân tán nào cũng là
dung dịch. Hệ phân tán là những hệ trong
đó có ít nhất một chất phân bố(
gọi là chất phân tán) vào một chất khác(
gọi là môi trường phân tán) dưới
dạng các hạt có kích thước nhỏ. Các
hệ phân tán có thể được phân
loại theo trạng thái tập hợp của
chất phân tán vào môi trường phân tán,
hoặc theo kích thước của các hạt
trong hệ phân tán, hoặc theo cường độ
tương tác giữa các hạt trong hệ phân
tán,...
Tùy thuộc vào trạng thái
tập hợp của chất phân tán và môi trường
phân tán mà ta sẽ có các hệ phân tán sau ( K =khí,
L = lỏng, R =rắn )
K-K
K-L K-R
L- K
L-L L-R
R-K
R-L R-R
Tuy nhiên do tính chất của
hệ phân tán phụ thuộc rất lớn vào kích
thước của các hạt nên sự phân
loại theo kích thước các hạt là có ý nghĩa
hơn cả. 
Hệ phân tán thô: kích thước
các hạt>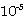 cm,
do đó có thể nhìn thấy các hạt bằng
mắt thường hoặc bằng kính hiển
vi quang học. Tùy thuộc trạng thái của
chất phân tán mà người ta phân biệt
dạng huyền phù hay nhũ tương. Dạng
huyền phù thu được khi có sự phân
bố hạt chất rắn trong chất lỏng,
ví dụ các hạt đất sét lơ lững
trong nước. Dạng nhũ tương thu
được khi có sự phân bố hạt
chất lỏng trong chất lỏng, ví dụ
sữa là hệ nhũ tương điển hình
gồm các hạt mở lơ lững trong
chất lỏng. cm,
do đó có thể nhìn thấy các hạt bằng
mắt thường hoặc bằng kính hiển
vi quang học. Tùy thuộc trạng thái của
chất phân tán mà người ta phân biệt
dạng huyền phù hay nhũ tương. Dạng
huyền phù thu được khi có sự phân
bố hạt chất rắn trong chất lỏng,
ví dụ các hạt đất sét lơ lững
trong nước. Dạng nhũ tương thu
được khi có sự phân bố hạt
chất lỏng trong chất lỏng, ví dụ
sữa là hệ nhũ tương điển hình
gồm các hạt mở lơ lững trong
chất lỏng.
Các hệ phân tán thô không
bền vì các hạt phân tán có kích thước
quá lớn so với các phân tử, ion nên dễ dàng
lắng xuống.
Hệ phân tán cao hay hệ keo:
Các hạt phân tán có kích thước trong
khoảng 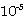 đến
đến  ,
do đó để quan sát được các
hạt phải dùng kính siêu hiển vi có độ
phóng đại lớn. Ví dụ cho loại
hệ này là gelatine, keo dán, sương mù, khói. Các
hệ keo cũng không bền vì các hạt keo
dễ liên hợp nhau thành hạt có kích thước
lớn hơn và lắng xuống. Các hệ keo có
nhiều tính chất rất đặc biệt và
có rất nhiều ứng dụng quan trọng
trong đời sống, do đó việc nghiên
cứu hệ keo đã trở thành một lĩnh
vực nghiên cứu độc lập gọi là hóa
keo. ,
do đó để quan sát được các
hạt phải dùng kính siêu hiển vi có độ
phóng đại lớn. Ví dụ cho loại
hệ này là gelatine, keo dán, sương mù, khói. Các
hệ keo cũng không bền vì các hạt keo
dễ liên hợp nhau thành hạt có kích thước
lớn hơn và lắng xuống. Các hệ keo có
nhiều tính chất rất đặc biệt và
có rất nhiều ứng dụng quan trọng
trong đời sống, do đó việc nghiên
cứu hệ keo đã trở thành một lĩnh
vực nghiên cứu độc lập gọi là hóa
keo.
Dung dịch: khi các hạt có kích
thước cở phân tử hay ion, nghĩa là có
kích thước< thì hệ phân tán trở thành đồng thể
và được gọi đơn giản là dung
dịch. Kích thước vô cùng bé nhỏ của
các hạt làm cho chúng phân bố đồng đều
trong môi trường và dẫn đến sự
đồng nhất về thành phần, cấu
tạo và tính chất trong toàn bộ thể tích
của hệ, cũng như làm cho hệ rất
bền không bị phá hủy khi để yên theo
thời gian. Ví dụ khi hòa tan đường và
muối ăn vào nước, các hạt đường
phân tán dưới dạng phân tử, còn các
hạt muối phân tán dưới dạng ion.
thì hệ phân tán trở thành đồng thể
và được gọi đơn giản là dung
dịch. Kích thước vô cùng bé nhỏ của
các hạt làm cho chúng phân bố đồng đều
trong môi trường và dẫn đến sự
đồng nhất về thành phần, cấu
tạo và tính chất trong toàn bộ thể tích
của hệ, cũng như làm cho hệ rất
bền không bị phá hủy khi để yên theo
thời gian. Ví dụ khi hòa tan đường và
muối ăn vào nước, các hạt đường
phân tán dưới dạng phân tử, còn các
hạt muối phân tán dưới dạng ion.
Từ các đặc điểm
đã nêu ta có thể định nghĩa dung
dịch như sau:
Dung dịch là hệ đồng
thể gồm hai hay nhiều chất mà thành
phần của chúng có thể thay đổi trong
một giới hạn rộng.
Ðịnh nghĩa này cho
thấy dung dịch giống hợp chất về
tính đồng nhất nhưng khác ở chổ
có thành phần thay đổi, trong khi đó
giống hỗn hợp cơ học ở chổ
có thành phần thay đổi nhưng khác ở tính
đồng nhất.
Bảng 5.1. Phân
loại hệ phân tán theo kích thước của
tiểu phân
|
Hệ
|
Kích thước
tiểu phân. Ðơn vị cm
|
Ðộ
bền theo
thời gian
|
Ví dụ
|
|
Hệ phán tán thô
-Huyền phù
-Nhũ tương
|
>10-5
|
Không bền
|
-Hạt sét lơ
lững trong nước.
-Sữa
|
|
Hệ keo
|
10-5 - 10-7
|
Không bền
|
Gelatin
|
|
Dung dịch
|
<10-7
|
Bền
|
NaCl tan trong nước
|
b). Trạng thái dung dịch

Trong hoá học chúng ta thường
làm việc với các dung dịch lỏng, do đó,
đối với nhiều người dung
dịch được hiểu là ở trạng
thái lỏng. Thực ra về mặt trạng thái
tập hợp, dung dịch có thể ở
trạng thái khí, lỏng hoặc rắn.
Bảng 5.2. Các trạng thái
tập hợp của dung dịch
|
Ví dụ
|
Trạng thái
của dung dịch
|
Trạng thái
của chất tan
|
Trạng thái
của dung môi
|
|
Không khí
|
Khí
|
Khí
|
Khí
|
|
Rượu trong nước
|
Lỏng
|
Lỏng
|
Lỏng
|
|
Thép
|
Rắn
|
Rắn
|
Rắn
|
|
Nước đường
|
Lỏng
|
Rắn
|
Lỏng
|
|
Soda
|
Lỏng
|
Khí
|
Lỏng
|
|
H2 tan trong Pd
|
Rắn
|
Khí
|
Rắn
|
c). Chất tan và dung môi
Như đã trình bày dung
dịch là hệ đồng nhất gồm các
chất phân tán vào nhau. Chất đóng vai trò môi
trường phân tán, gọi là dung môi. Các
chất còn lại đóng vai trò chất phân tán,
gọi là chất tan. Với định nghĩa này
ta thấy ranh giới phân biệt giữa chất
tan và dung môi là không rõ rệt.
Thông thường dung môi
được hiểu là chất có trạng thái
tập hợp không thay đổi khi hình thành dung
dịch nếu các chất ban đầu khác nhau
về trạng thái, hoặc dung môi là chất
chiếm lượng lớn khi tạo thành dung
dịch nếu các chất ban đầu cùng
trạng thái. Ðôi khi người ta có thể
sử dụng một tính chất cụ thể nào
đó để xác định dung môi, ví dụ:
đối với các hệ rắn-lỏng, khí-lỏng
thì dung môi là chất lỏng hoặc dung môi
sẽ là chất kết tinh đầu tiên khi làm
lạnh dung dịch.
d). Dung dịch loãng, đậm
đặc, chưa bảo hòa, quá bảo hòa,
độ tan
Khi hoà tan đường vào nước,
đường đóng vai trò chất tan, nước
đóng vai trò dung môi. Nếu lượng
đường tan trong nước ít, ta có dung
dịch nước đường loãng. Nếu lượng
đường tan trong nước thật
nhiều, ta có dung dịch nước đường
đậm đặc. Vậy ta có thể
hiểu:
- Dung dịch loãng là dung
dịch chứa một lượng ít chất tan.
- Dung dịch đậm đặc
là dung dịch chứa một lượng lớn
chất tan.
Nếu tiếp tục thêm
đường vào dung dịch, ta thấy
đường tiếp tục tan ra, dung dịch bây
giờ sẽ chứa một lượng
đường nhiều hơn ban đầu. Nhưng
nếu tiếp tục thêm đường đến
một lúc nào đó ta thấy đường không
thể hòa tan thêm được nữa ở
một nhiệt độ xác định, lúc này
ta có dung dịch nước đường
bảo hòa và lúc này lượng đường
có trong dung dịch bằng độ tan của nó.
Tổng quát ta hiểu như sau:
- Dung dịch chưa bảo hòa
là dung dịch mà chất tan có thể tiếp
tục tan thêm.
- Dung dịch bảo hòa là dung
dịch mà chất tan không thể tan thêm
được nữa ở một nhiệt độ
xác định.
- Ðộ tan là lượng
chất tan được vào dung dịch để
tạo ra một dung dịch bảo hòa ở
một nhiệt độ xác định.
Bây giờ nếu ta nâng
nhiệt độ dung dịch lên cao hơn,
đường sẽ tiếp tục hòa tan . Khi làm
nguội dung dịch về nhiệt độ ban
đầu t0C thì lượng đường dư
so với độ tan ở nhiệt độ t0C
sẽ kết tinh tách ra khỏi dung dịch và có
sự hình thành trở lại dung dịch bảo
hòa. Trong một số trường hợp, quá trình
kết tinh có thể xảy ra lập tức
hoặc sẽ xảy ra khi ta thêm vào đó vài
tinh thể của chất tan, hoặc lắc dung
dịch. Dung dịch chứa một lượng
chất tan vượt quá so với độ tan
được gọi là dung dịch quá bảo hòa,
Sirô là dung dịch nước đường quá
bảo hòa mà chúng ta thường gặp.
Do thành phần của dung
dịch có thể thay đổi nên mối quan
hệ về lượng của các chất trong
dung dịch phải được xác định
rõ ràng và có nhiều cách khác nhau để xác
định mối quan hệ đó .
a). Nồng độ
phần trăm khối lượng (%)
Số gam chất tan trong 100 gam
dung dịch.
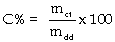
Ví dụ 5.1. Dung dịch NaOH
20% nghĩa là cứ 100g dung dịch thì có 20g NaOH
tan trong đó.
b). Phân mol
Là tỉ lệ giữa số
mol chất nào đó với tổng số mol
của các chất trong dung dịch. Ðối
với dung dịch tạo thành từ hai chất
A, B với số mol tương ứng là 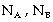 , ta có biểu thức phân mol như sau:
, ta có biểu thức phân mol như sau:

c). Nồng độ molan (m)
Số mol của chất tan có
trong 1kg hoặc 1000g dung môi.


d). Nồng độ mol
Số mol chất tan có trong 1 lít
dung dịch
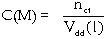
Ví dụ 5.2. Dung dịch  .
Ta có thể chọn một loại nồng độ
nào đó để sử dụng sao cho tiện
lợi với yêu cầu định lượng. .
Ta có thể chọn một loại nồng độ
nào đó để sử dụng sao cho tiện
lợi với yêu cầu định lượng.
Ví dụ 5.3. Khi trộn
lẫn 1,00g etanol với 100,0g nước ta thu
được dung dịch có thể tích là 101ml.
Tính: nồng độ molan. Phân mol của etanol
trong dung dịch.
Giải:
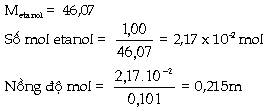

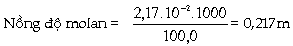
e). Nồng độ
đương lượng
Một loại nồng độ
khác thường được sử dụng
để tính toán trong các phương pháp phân tích
thể tích là nồng độ đương lượng
được định nghĩa là số
đương lượng gam của chất tan
trong một lít dung dịch. Từ nồng độ
mol ta có thể dễ dàng tính được
nồng độ đương lượng theo
biểu thức:
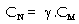
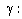 là số đương lượng gam ứng
với 1 mol chất tan.
là số đương lượng gam ứng
với 1 mol chất tan.
Ví dụ 5.4. Ta có dung dịch 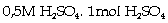 ứng với số đương lượng
gam là 2.
ứng với số đương lượng
gam là 2.
Do đó 
Nói chung ta đều có
thể thực hiện sự chuyển đổi
qua lại giữa các loại nồng độ, và
qua đó biết được thành phần
của dung dịch.
Ví dụ 5.5. Dung dịch
sử dụng bình acqui là dung dịch H2SO4 3,75M, có
khối lượng riêng là: 1,230 g/ml.
Tính nồng độ %, nồng độ molan và
nồng độ đương lượng
của H2SO4 trong dung dịch trên.
Giải:
Khối lượng của 1 lít
dung dịch: 1000 x 1,230 = 1230g.
Khối lượng của
H2SO4 trong 1 lít dung dịch: 3,75 x 98 = 368g.
Khối lượng của H2O
trong 1 lít dung dịch: 1230 - 368 = 862g.
Do đó:
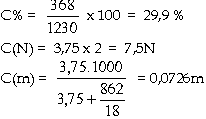
a). Nhiệt hòa tan
Khi hòa tan NaOH vào nước
ta thấy dung dịch nóng lên, ngược lại
khi hòa tan urê vào nước thì ta lại thấy
dung dịch lạnh đi. Ðiều này chứng
tỏ khi hòa tan chất tan vào dung môi không chỉ
đơn thuần xảy ra quá trình khuếch tán
các tiểu phân chất tan vào các tiểu phân
của dung môi, mà còn xảy ra quá trình tương
tác giữa các tiểu phân đó với nhau.
Những lực tương tác giữa các
tiểu phân của chất tan và dung môi cũng chính
là những lực tương tác quyểt định
trạng thái tập hợp của các chất. Chúng
có bản chất vật lý như lực hút tĩnh
điện, lực Van Der Waals... Hoặc bản
chất hóa học như tương tác
cho-nhận, lực liên kết hydro... Các lực tương
tác thứ nhất gắn liền với các quá
trình vật lý và chỉ thể hiện trên
những khoảng cách lớn hơn kích thước
phân tử. Những lực tương tác thứ
hai được thực hiện trên những
khoảng cách gần với sự tham gia của các
obitan nguyên tử và phân tử.
Sự khuếch tán các
tiểu phân chất tan vào dung môi là nguyên nhân làm
cho nồng độ dung dịch đồng đều
trong toàn bộ thể tích dung dịch.
Trong trường hợp
tổng quát các quá trình vật lý bao gồm các
quá trình phá vỡ mạng tinh thể, quá trình
khuếch tán chất tan vào dung môi,... Gọi chung
là quá trình chuyển pha.
Quá trình hóa học bao gồm
tất cả các quá trình tương tác để
tạo thành những hợp chất có thành
phần thay đổi giữa chất tan và dung môi
được gọi là sự solvat hóa, nếu
dung môi là nước thì được gọi là
sự hidrat hóa.
Trong đa số trường
hợp các quá trình vật lý thường tương
ứng với quá trình thu nhiệt, còn các quá trình
hóa học thường ứng với quá trình
tỏa nhiệt. Tùy chất tan và dung môi, cũng
như tùy nhiệt độ và áp suất mà
một trong hai quá trình sẽ chiếm ưu
thế, kết quả dẫn đến là quá trình
hòa tan sẽ tỏa nhiệt hay thu nhiệt.
Người ta định nghĩa
Lượng nhiệt thu vào hay phát ra khi hòa tan
một mol chất tan được gọi là
nhiệt hòa tan.
Ðể hiểu rõ hơn ta xét
trường hợp hòa tan chất rắn vào dung
môi lỏng, ví dụ hòa tan NaCl vào nước, quá
trình có thể chia làm 3 bước:
Bước 1 Phá vỡ
cấu trúc tinh thể của chất tan để
tạo thành tiểu phân riêng biệt.
Quá trình này đặc trưng bằng giá trị

Bước 2 Phá vỡ
lực liên kết liên phân tử giữa các phân
tử dung môi để tạo ra các
khoảng trống cho các tiểu phân của các
chất tan xâm nhập. Quá trình được
đặc trưng bằng 
Bước 3 Xảy ra tương
tác giữa các tiểu phân của chất tan và các
phân tử của dung môi để
tạo thành dung dịch, tức xảy ra quá trình
solvat hóa. Quá trình này đặc trưng bằng
giá trị  .
chính là tổng của 3 giá trị trên. .
chính là tổng của 3 giá trị trên.

Tùy quá trình nào chiếm ưu
thế mà giá trị 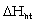 có thể (+) hoặc (-) hay nói cách khác quá trình hòa
tan thu nhiệt hoặc tỏa nhiệt.
có thể (+) hoặc (-) hay nói cách khác quá trình hòa
tan thu nhiệt hoặc tỏa nhiệt.
Ðối với quá trình hòa tan
NaCl trong nước, giá trị 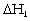 phải lớn và có dấu (+) do phải tốn
nhiều năng lượng để bẻ gãy
lực hút giữa các ion trong tinh thể. Giá
trị
phải lớn và có dấu (+) do phải tốn
nhiều năng lượng để bẻ gãy
lực hút giữa các ion trong tinh thể. Giá
trị 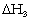 cũng rất lớn và có dấu (-) vì xảy ra
tương tác rất mạnh giữa các ion
cũng rất lớn và có dấu (-) vì xảy ra
tương tác rất mạnh giữa các ion 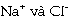 với các phân tử H2O.
với các phân tử H2O.
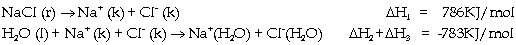
Từ đây ta có nhiệt hòa
tan NaCl trong nước là:
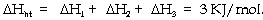
Về mặt nhiệt động
học, một quá trình nếu đòi hỏi cung
cấp năng lượng càng lớn thì càng khó
xảy ra. Quá trình hòa tan NaCl vào nước
chỉ đòi hỏi một năng lượng tương
đối nhỏ, do đó có thể xảy ra
một cách tự nhiên. Giá trị 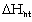 chính là biến đổi entalpi của quá trình hòa
tan.
chính là biến đổi entalpi của quá trình hòa
tan.
Tuy nhiên ở đây chưa
thể giải thích được tại sao NaCl
tan tốt trong nước. Theo nguyên lý II của
nhiệt động lực học một quá trình
xảy ra tự nhiên là một quá trình tiến
đến một trạng thái xáo trộn cao hơn.
Do đó NaCl tan tốt vì tuy phải cung cấp
một năng lượng nhỏ nhưng
trạng thái dung dịch đạt độ xáo
trộn lớn hơn rất nhiều so với ban
đầu, kết quả là có sự hình thành
dung dịch NaCl khi hòa tan NaCl vào nước. Các
kết quả thu được ở đây hoàn
toàn phù hợp với qui luật kinh nghiệm
về độ tan là <Các chất có cùng tính
phân cực thì hòa tan tốt vào nhau>.
Bảng 5.3. Yếu tố năng
lượng của quá trình hình thành dung dịch

từ các chất tan và dung môi khác nhau
|
Bản
chất của các chất
|
DH1
|
DH2
|
DH3
|
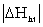
|
Kết
quả
|
|
Dung môi phân
cực-chất tan phân cực
|
(+)
lớn
|
(+)
lớn
|
(-)
lớn
|
nhỏ
|
Hình thành dung dịch
|
|
Dung môi phân
cực-chất tan không phân cực
|
(+)
nhỏ
|
(+)
lớn
|
(-)
nhỏ
|
(+)
lớn
|
Khó hình thành dung dịch
|
|
Dung môi không phân
cực-chất tan không phân cực
|
(+)
nhỏ
|
(+)
nhỏ
|
(-)
nhỏ
|
nhỏ
|
Hình thành dung dịch
|
|
Dung môi không phân
cực-chất tan phân cực
|
(+)
lớn
|
(+)
nhỏ
|
(-)
nhỏ
|
lớn
(+)
|
Khó hình thành dung dịch
|
b). Dung dịch lý tưởng

Khi khảo sát quá trình hòa tan
về phương diện động lực
học như đã trình bày người ta
nhận thấy có những trường hợp mà
dung dịch được hình thành với  .
Ðó là trường hợp khi hòa tan vào nhau các
chất không cực và giống nhau về cấu
trúc, liên kết hóa học, ví dụ như pental
và hexan. Trong những dung dịch như thế
lực tương tác của những phân tử
cùng loại và khác loại giống nhau. Những
dung dịch như vậy được gọi là
dung dịch lý tưởng. Ðộng lực duy
nhất để đưa đến sự hình
thành các dung dịch lý tưởng chính là sự
gia tăng độ xáo trộn, tức gia tăng
entropy của dung dịch với các chất riêng
lẻ ban đầu. Ðối với dung dịch lý
tưởng tính chất của dung dịch không
phụ thuộc vào bản chất của chất
tan mà chỉ phụ thuộc vào nồng độ
của chúng. .
Ðó là trường hợp khi hòa tan vào nhau các
chất không cực và giống nhau về cấu
trúc, liên kết hóa học, ví dụ như pental
và hexan. Trong những dung dịch như thế
lực tương tác của những phân tử
cùng loại và khác loại giống nhau. Những
dung dịch như vậy được gọi là
dung dịch lý tưởng. Ðộng lực duy
nhất để đưa đến sự hình
thành các dung dịch lý tưởng chính là sự
gia tăng độ xáo trộn, tức gia tăng
entropy của dung dịch với các chất riêng
lẻ ban đầu. Ðối với dung dịch lý
tưởng tính chất của dung dịch không
phụ thuộc vào bản chất của chất
tan mà chỉ phụ thuộc vào nồng độ
của chúng.
c). Ảnh hưởng
của cấu trúc chất tan đến độ
tan
Như đã đề cập
<chất có cùng bản chất phân cực hòa
tan tốt vào nhau>, mà sự sự phân cực
của một chất được xác định
bởi cấu trúc của nó, do đó, giữa
cấu trúc và độ tan có một mói quan
hệ xác định. Các vitamin là những ví
dụ tiêu biểu cho thấy ảnh hưởng
của cấu trúc đến độ tan.
Ta có thể phân vitamin ra làm
hai nhóm chính: tan trong dầu (vitamin A, D, E, K) và tan
trong nước (vitamin B, C). Vitamin A được
cấu tạo chủ yếu bởi C và H, có ái
lực electron tương đương nhau nên
trong phân tử không xảy ra sự phân cực liên
kết đáng kể và do đó là chất không
phân cực. Ðiều này cho thấy chúng dễ dàng
tan trong các dung môi không phân cực, ví dụ như
dầu mỡ, và không tan trong các dung môi phân
cực, ví dụ như nước.
Hình 5.1 Cấu
tạo của Vitamin A và Vitamin C

Các vitamin tan trong dầu có thể hình thành
và tích trữ tại các mô mỡ trong cơ
thể. Do đó ta chịu đựng
được một thời gian dài nếu trong
chế độ ăn uống thiếu các
loại vitamin trên. Ngược lại, nếu chúng
quá dư có thể dẫn đến chứng
bệnh gọi là thừa vitamin (hypervitaminosis).
Ðối với các vitamin tan
trong nước, chúng dễ dàng bị cơ
thể thải bỏ và do đó phải
được bổ sung thường xuyên. Trước
đây người ta phát hiện bệnh phù
chảy máu của các thủy thủ sống xa
đẩt liền do thiếu vitamin C, căn
bệnh này được chặn đứng
bằng cách bổ sung đầy đủ vitamin
C.
d). Ảnh hưởng
của áp suất đến độ tan
Áp suất ảnh hưởng
không đáng kể đến độ tan
của chất rắn hoặc lỏng, nhưng có
tác động lớn đến độ tan
của chất khí. Các loại nước
giải khát chứa ga khi đóng chai phải
ở áp suất CO2 cao nhằm bảo đảm
đạt được một nồng độ
lớn của CO2 trong dung dịch. Khi mở
nắp, do áp suất của CO2 trong khí quyển bé
nên xảy ra sự thoát CO2 khỏi dung dịch
tạo nên tiếng bọt vỡ đặc trưng.
Sự gia tăng độ tan
của khí trong dung dịch có thể được
minh họa trong ví dụ sau: giả sử đang
xảy ra cân bằng giữa chất khí và
chất lỏng, nghĩa là số phân tử khí
thoát ra hoặc tan vào dung dịch với tốc
độ bằng nhau. Nếu ta làm tăng áp
suất, số phân tử khí trong một
đơn vị thể tích sẽ gia tăng, khí
sẽ tan vào dung dịch với tốc độ
lớn hơn tốc độ thoát ra, lúc này
nồng độ khí tan trong dung dịch sẽ tăng
cho đến khi một cân bằng mới
được thiết lập, và dĩ nhiên lúc
này dung dịch sẽ chứa một lượng
khí tan nhiều hơn.
Mối liên hệ giữa áp
suất và nồng độ khí tan trong dung
dịch được thể hiện qua phương
trình:
P = kC.
Với P là áp suất riêng
phần của khí tan trên bề mặt dung
dịch.
C là nồng độ của
khí tan trong dung dịch
k là hằng số đặc
trưng của mỗi loại dung dịch.
Ðây là phương trình toán
học của định luật Henry, nó thể
hiện nội dung sau: <lượng khí tan
trong dung dịch tỉ lệ với áp suất riêng
phần của nó>.
Ðiều quan trọng cần
phải chú ý là định luật Henry chỉ
đúng trong trường hợp khí tan không
phản ứng với dung môi, ví dụ: đúng
với trường hợp khí O2 tan trong nước,
nhưng không đúng với trường hợp
HCl tan trong nước vì ở đây xảy ra
sự phân ly của HCl.
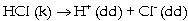
Ví dụ 5.6. Một loại nước
giải khát được đóng nắp ở
250C chứa khí CO2 với áp suất trên bề
mặt dung dịch là 5 atm. Nếu áp suất riêng
phần của CO2 trong khí quyển là 4,0.10-4 atm, hãy
tính nồng độ CO2 trong dung dịch trước
và sau khi mở nắp. Hằng số Henry của
CO2 trong dung dịch là 32 l.atm/mol ở 250C.

Giải
Áp dụng định luật
Henry ta có:
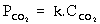
K = 32 l.atm/mol.

Khi mở nắp, CO2 trong dung
dịch thoát ra và đạt đến trạng
thái cân bằng với áp suất của  atm,
do đó: atm,
do đó:

e). Ảnh hưởng
của nhiệt độ đến độ tan
Việc hòa tan các chất
rắn vào nước, ví dụ hòa tan đường
hay muối vào nước, mà ta gặp hằng ngày
có thể làm ta đi đến kết luận
rằng độ tan của các chất tăng
theo nhiệt độ. Thực sự không
phải như vậy. Nhiệt độ cao giúp
quá trình hòa tan xảy ra nhanh hơn nhưng lượng
chất tan có thể giảm đi theo nhiệt
độ.
Ảnh hưởng của
nhiệt độ đến độ tan của
các một số chất tan rắn trong nước
được trình bày ở hình 5.2. Ta thấy
rằng đa số các chất có độ tan tăng
khi tăng nhiệt độ, nhưng cũng có
một số chất có độ tan giảm khi tăng
nhiệt độ như: Na2SO4, Ce2(SO4)3...
Rất khó để mà tiên
đoán sự phụ thuộc của độ
tan của một chất theo nhiệt độ.
Do đó phương pháp tốt nhất là
kiểm tra bằng thực nghiệm.

Hình 5.2. Sự phụ thuộc của độ tan của một số chất rắn theo nhiệt độ
Ðối với chất khí thì
hầu như là độ tan giảm khi tăng
nhiệt độ.
Hình 5.3. Sự
phụ thuộc độ tan của các chất khí
khác nhau trong nước theo nhiệt độ
ở áp suất 1 atm
Ảnh hưởng của
nhiệt độ đối với độ tan
của các chất khí có ý nghĩa quan trọng
về mặt môi trường. Một lượng
lớn nước được sử dụng
để làm nguội trong các qui trình công
nghiệp, sau khi sử dụng sẽ bị nóng lên
và được thải trở lại sông
hồ. Do nóng hơn nên nước sẽ chứa
ít lượng O2 hòa tan hơn, điều này làm
phá vỡ cân bằng hấp phụ O2, làm
giảm lượng O2 hòa tan trong nước và do
vậy ảnh hưởng đến hoạt
động sống của các sinh vật sống
trong nước.
Do kết quả tương tác
xảy ra giữa các tiểu phân của chất
tan và dung môi, cũng như do sự giảm
nồng độ các tiểu phân tự do của
dung môi trong quá trình tạo thành dung dịch mà tính
chất của chất tan, dung môi thay đổi và
khác với tính chất của dung dịch thu
được. Ðiều này được
chứng minh rõ ràng với hiệu ứng
nhiệt, hiệu ứng thể tích, độ tăng
nhiệt độ sôi, hạ nhiệt độ
đông đặc của dung dịch so với
dung môi tinh chất.
Khi nồng độ chất
tan tăng, ảnh hưởng của các yếu
tố nói trên tăng mạnh làm cho tính chất
của dung dịch trở nên phức tạp hơn.
Việc nghiên cứu tính chất của các dung
dịch đó rất khó, do đó, đến nay
vẫn chưa có lý thuyết định lượng
đối với những dung dịch có nồng
độ cao.
Ðối với các dung dịch
có nồng độ chất tan nhỏ, đặc
biệt ở những nồng độ rất
nhỏ, các ảnh hưởng của những
yếu tố nói trên có thể bỏ qua, do đó
dung dịch trở thành gần với lý tưởng,
nghĩa là không có hiệu ứng nhiệt và
hiệu ứng thể tích. Trong những trường
hợp như vậy tính chất của dung môi
hầu như không thay đổi, còn các tính
chất của dung dịch thì có một số
thay đổi phụ thuộc bản chất
chất tan, ví dụ như sự thay đổi màu
sắc, nhưng có một số tính chất khác
chỉ phụ thuộc nồng độ chất
tan như áp suất hơi bảo hòa, nhiệt
độ sôi, nhiệt độ đông đặc,
áp suất thẩm thấu. Việc nghiên cứu các
tính chất này tương đối đơn
giản và đã xây dựng được lý
thuyết định lượng hoàn chỉnh
về chúng đối với các dung dịch
lỏng và loãng.
Dưới đây sẽ
lần lượt khảo sát các tính chất
đó.
a). Áp suất hơi của
dung dịch
Các dung dịch lỏng có áp
suất hơi khác đáng kể so với dung môi
tinh chất. Ðể hiểu được sự
ảnh hưởng này chúng ta xem xét thí nghiệm
sau:

Có hai cốc: một cốc
đựng nước tinh chất và một
cốc đựng dung dịch nước
đường, đặt trong một chậu
thủy tinh như hình 5.4. Sau một thời gian ta
thấy thể tích của nước giảm còn
thể tích của dung dịch nước
đường tăng.
Hình 5.4. Thí nghiệm
khảo sát ảnh hưởng của chất tan
đến tính chất của dung môi
Ðiều này chỉ có thể
giải thích được khi áp suất hơi
của dung môi tinh chất phải lớn hơn áp
suất hơi của dung dịch chứa chất
tan không bay hơi, nghĩa là nếu hai bình độc
lập nhau thì khi cân bằng lỏng hơi
được thiết lập áp suất hơi
tạo ra trên bề mặt dung môi tinh chất
phải lớn hơn áp suất hơi tạo ra
trên bề mặt dung dịch. Do đó trong
một hệ kín sự hóa hơi mạnh của
dung môi tinh chất làm cân bằng lỏng hơi
của dung dịch bị dịch chuyển theo
chiều dung dịch phải hấp thụ hơi
để làm giảm áp suất hơi trên bề
mặt dung dịch. Sự hấp thụ hơi
dung môi trên bề mặt dung dịch làm giảm
áp suất hơi của dung môi trong hệ. Ðể
đạt cân bằng lỏng hơi trở
lại dung môi tinh chất phải bốc hơi thêm,
do đó cân bằng lỏng hơi của dung môi
tinh chất bị dịch chuyển theo chiều làm
tăng áp suất hơi của dung môi tinh
chất, kết quả là xảy ra sự
chuyển dung môi tinh chất sang dung dịch.
Sự hiện diện của
chất tan trong dung dịch làm giảm số phân
tử dung môi tự do trong một đơn
vị thể tích, do đó làm giảm số phân
tử dung môi trên bề mặt và do đó làm
giảm khả năng hóa hơi của dung môi.
Các nghiên cứu về áp
suất hơi của dung dịch lỏng lý tưởng
chứa chất tan không bay hơi được
thực hiện bởi Francois M.Raoult và được
công thức hóa như sau:
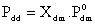

Ðường biểu diễn
phương trình của định luật Raoult
có dạng đường thẳng:

y = ax + b.
Với: 
Ví dụ 5.7. Tính áp suất hơi
của dung dịch được tạo thành
bằng cách hòa tan 158,0g đường Saccaroz (M =
342,3g) trong  ,
khối lượng riêng của nước tinh
chất là 0.9971g/cm3 và áp suất hơi của nước
tinh chất là 23,76mmHg. ,
khối lượng riêng của nước tinh
chất là 0.9971g/cm3 và áp suất hơi của nước
tinh chất là 23,76mmHg.
Giải


Trong trường hợp
chất tan bay hơi, thường gặp đối
với các dung dịch lỏng-lỏng lý tưởng,
phương trình mở rộng của dịnh
luật Raoult có dạng.
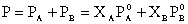
Với:


Các dung dịch lý tưởng
nghiệm đúng phương trình của định
luật Raoult. Nếu phương trình không
được nghiệm đúng ta có sự sai
lệch. Sự sai lệch này có thể âm
hoặc dương, nghĩa là áp suất hơi
dung dịch có thể nhỏ hơn hoặc
lớn hơn so với khi tính toán bằng phương
trình Raoult. Ðối với dung dịch chứa
chất tan không bay hơi thường gặp
sự sai lệch nhiều hơn so với dung
dịch chứa chất tan bay hơi.
Ðồ thị biểu diễn
sự phụ thuộc áp suất hơi của
dung dịch chứa chất tan bay hơi theo phân
mol của dung môi và chất tan được
thể hiện ở hình 5.5.
Hình 5.5. Sự
phụ thuộc của áp suất hơi của
dung dịch chứa chất tan bay hơi theo
phân mol của dung môi và chất tan trong trường
hợp lý tưởng và có xảy ra sai lệch

1: áp suất hơi dung
dịch.
2: áp suất riêng phần
của B.
3: áp suất riêng phần
của A.
Ðối với các dung dịch
mà tương tác giữa chất tan- chất tan,
dung môi-dung môi, chất tan- dung môi có cùng bản
chất thì tính chất của dung dịch càng
gần với tính chất của dung dịch lý tưởng.
Trong trường hợp này chất tan chỉ làm
nhiệm vụ pha loãng dung môi và ngược
lại.
Ví dụ 5.8. Dung dịch
benzen-toluen chúng có cùng bản chất là không phân
cực. Entanpy hòa tan coi như bằng
0, dung dịch này rất gần dung dịch lý tưởng
và có thể xem là dung dịch lý tưởng.
Trong một số trường
hợp dung môi có thể có những ái lực
đặc biệt đối với chất tan, ví
dụ như tạo được liên kểt
hydro đối với chất tan, lúc này khả năng
hóa hơi của chất tan cũng như dung môi
trong dung dịch đều giảm và do đó áp
suất hơi của dung dịch nhỏ hơn so
với tính toán bằng phương trình Raoult, ta
có sự sai lệch âm, ví dụ: dung dịch
aceton trong nước có sai lệch âm vì xảy ra
liên kết hydro giữa aceton và nước.

Ngược lại nếu tương
tác giữa chất tan-dung môi yếu hơn tương
tác giữa các phân tử của chất tinh
chất thì khi hình thành dung dịch nhiệt hòa
tan thường có giá trị (+) vì cần năng
lượng để làm dãn khoảng cách
giữa các phân tử chất tan và dung môi khi chúng
được trộn lẫn vào nhau. Trong trường
hợp này các phân tử chất tan cũng như
dung môi có khuynh hướng hóa hơi mạnh hơn,
ta có dung dịch sai lệch (+), nghĩa là áp
suất hơi của dung dịch sẽ lớn hơn
so với giá trị tính toán bằng phương
trình Raoult. Ví dụ về trường hợp này
là dung dịch etanol-hexan. Các phân tử etanol phân
cực, các phân tử hexan không phân cực, chúng
tương tác với nhau rất yếu. Entanpy hòa
tan có giá trị (+)xảy ra sự sai lệch dương.
Bảng 5.4. Bảng tóm tắt tính
chất của các loại dung dịch khác nhau

Ví dụ 5.9. Một dung
dịch được điều chế bằng
cách hòa tan 5,81g aceton vào 11,9g Cloroform. Ở 350C dung
dịch có áp suất hơi là 260mmHg. Ðây là dung
dịch lý tưởng hay không? Biết áp
suất hơi của aceton và cloroform ở 350C là
345 và 293mmHg.
Giải:
Muốn biết dung dịch có
lý tưởng không ta tính áp suất hơi
của dung dịch theo phương trình Raoult
rồi so sánh với giá trị thực nghiệm.


Theo thực nghiệm giá
trị đo được là 260mmHg, vậy đây
là dung dịch không lý tưởng.

Ở đây có sự giảm
áp suất hơi của dung dịch nhiều hơn
dự kiến tức xảy ra sự sai lệch
âm. Ðiều này cho thấy giữa chất tan và
dung môi phải tương tác nhau mạnh.
Thực vậy, giữa aceton và cloroform hình thành
liên kết hydrogen.
Ýï nghĩa của sự
giảm áp suất hơi của dung dịch
chứa chất tan không bay hơi cho ta một phương
pháp thực tiển để đếm số phân
tử và qua đó giúp ta xác định được
phân tử lượng của một chất chưa
biết. Dùng phương trình Raoult chúng ta
biết được số phân tử chất
tan hiện diện, và do đó chúng ta đã
biết khối lượng tương ứng nên
sẽ xác định được phân tử lượng.
Ví dụ 5.10. Một dung
dịch được điều chế bằng
cách hòa tan 20,0g urea vào 125g nước ở 250C. Áp
suất hơi của dung dịch đo được
ở 250C là 22,67mmHg. Xác định phân tử lượngcủa
urea biết áp suất hơi của nước
tinh chất ở nhiệt độ trên là
23,76mmHg.


Phân tử lượng đúng
của urea là 60,0. Kết quả thực nghiệm
phù hợp tốt với thực tế.
Một ý nghĩa khác nữa là
có thể dùng định luật Raoult để
nghiên cứu tính chất của dung dịch. Khi hòa
tan 1 mol NaCl vào nước thì người ta
thấy rằng áp suất hơi dung dịch
giảm gấp 2 lần so với dự kiến
bởi vì các phân tử NaCl khi hòa tan vào nước
phân ly hoàn toàn thành ion nên tiểu phân trong dung
dịch tăng lên gấp đôi, mà độ
giảm áp suất hơi của dung dịch thì
tỉ lệ với số lượng tiểu phân
có trong dung dịch. Thí nghiệm này khẳng định
NaCl phân ly hoàn toàn khi hòa tan vào nước là
đúng.
Ví dụ 5.11. Dự đoán áp
suất hơi của dung dịch được
điều chế bằng cách hòa tan 
Giải:

Khi hòa tan vào nước,  do đó số tiểu phân tan trong dung dịch tăng
lên 3 lần nên cũng sẽ ứng với
số mol là:
do đó số tiểu phân tan trong dung dịch tăng
lên 3 lần nên cũng sẽ ứng với
số mol là:

b). Ðộ tăng nhiệt
độ sôi
Nhiệt độ sôi bình thường
của một chất lỏng được
định nghĩa là nhiệt độ lúc đó
áp suất hơi của chất lỏng đạt
được 1 atm. Các chất tan không bay hơi
làm giảm áp suất hơi của dung dịch,
do đó dung dịch phải được đun
nóng đến nhiệt độ cao hơn
nhiệt độ sôi của dung môi tinh chất
mới có thể đạt được áp
suất 1atm. Ðiều này có nghĩa là chất tan
không bay hơi làm tăng nhiệt độ sôi
của dung môi. Mức độ gia tăng
nhiệt độ sôi phụ thuộc vào nồng
độ của chất tan trong dung dịch. Ðối
với các dung dịch loãng mối quan hệ đó
được biểu diễn bằng phương
trình:

Với: T: độ tăng
nhiệt độ sôi so với dung môi tinh
chất.
 gọi là hằng số nghiệm sôi phụ
thuộc vào bản chất dung môi.
gọi là hằng số nghiệm sôi phụ
thuộc vào bản chất dung môi.
 nồng độ molan của chất tan trong dung
dịch.
nồng độ molan của chất tan trong dung
dịch.
Bảng 5.5. Giá
trị KS và Kđ của một số dung môi khác
nhau
|
Dung môi
|
Nhiệt độ
sôi (C)
|
Ks0C.Kg/mol
|
Nhiệt độ
|
Kd0C.Kg/mol
|
|
Nước
|
100,0
|
0,51
|
0
|
1,86
|
|
CCl4
|
76,5
|
5,03
|
-22,99
|
3,00
|
|
CHCl3
|
61,2
|
3,63
|
-63,5
|
4,70
|
|
C6H6
|
80,1
|
2,53
|
5,5
|
5,12
|
|
CS2
|
46,2
|
2,34
|
-111,5
|
3,83
|
|
Ête etylic
|
34,5
|
2,02
|
-116,2
|
1,79
|
|
Camphor
|
208,0
|
5,95
|
179,8
|
40
|
Dựa vào độ tăng
nhiệt độ sôi so với dung môi tinh
chất ta có thể xác định được
phân tử lượng của chất tan trong dung
dịch.
Ví dụ 5.12. Một dung
dịch được điều chế bằng
cách hòa tan 18,00g Glucô trong 150,00g nước. Dung
dịch có nhiệt độ sôi là 100,340C. xác
định phân tử lượng của Glucô,
biết hằng số nghiệm sôi của nước
là 0,510C.Kg/mol.
Giải:


c). Ðộ hạ nhiệt
độ đông đặc
Người ta định nghĩa
nhiệt độ đông đặc của
một chất lỏng là nhiệt độ mà lúc
đó áp suất hơi của pha lỏng bằng
với áp suất hơi của pha rắn, cụ
thể đối với nước tinh chất có
nhiệt độ đông đặc là 00C (chính
xác là 0,00990C) ứng với áp suất hơi
bảo hòa của nước đá và nước
lỏng là 0,006atm. Việc hòa tan chất tan vào nước
sẽ làm cho dung dịch có nhiệt độ
đông đặc thấp hơn nước tinh
chất, bởi vì sự hiện diện của
chất tan trong nước sẽ làm cho áp
suất hơi của nước trong dung dịch
thấp hơn áp suất hơi của nước
đá, do đó tại nhiệt độ này dung
dịch không thể đông đặc vì không có
sự bằng nhau của áp suất hơi
giữa pha lỏng và pha rắn. Nếu ta hạ
nhiệt độ, áp suất hơi của pha
rắn giảm nhanh hơn pha lỏng, kết
quả sẽ dẫn đến sự cân bằng
áp suất hơi của 2 pha lỏng và rắn và
lúc này dung dịch sẽ đông đặc.
Do chất tan làm hạ
nhiệt độ đông đặc của nước,
nên các chất như NaCl, CaCl2 thường
được rãi trên vĩa hè hoặc đường
để tránh sự đóng băng trong mùa đông
ở các nước Châu Âu, dĩ nhiên với
điều kiện nhiệt độ bên ngoài không
quá thấp.

Hình 5.6. Giản
đồ pha của cân bằng lỏng / hơi và
lỏng / rắn
của dung dịch nước chứa chất tan
không bay hơi
Từ giản đồ ta có
thể kết luận: sự hiện diện
của chất tan không bay hơi làm mở
rộng khoảng nhiệt độ mà dung
dịch tồn tại ở trạng thái
lỏng-cũng giống như độ tăng
nhiệt độ sôi-độ hạ nhiệt
độ đông đặc của dung dịch so
với dung môi tinh chất phụ thuộc vào
nồng độ của chất tan, phương
trình biểu diễn sự liên hệ, đối
với dung dịch loãng, cũng có dạng tương
tự và cũng được dùng để xác
định phân tử lượng của các
chất tan.

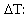 độ hạ nhiệt độ đông đặc
của dung dịch so với dung môi tinh chất.
độ hạ nhiệt độ đông đặc
của dung dịch so với dung môi tinh chất.
Kd : hằng
số nghiệm đông phụ thuộc vào
bản chất dung môi.
m ct: nồng độ
molan của chất tan.
Giá trị hằng số Kd
của một số dung dịch khác nhau được
trình bày ở bảng 5.5.
Ví dụ 5.13a. Tính gần
đúng khối lượng của etylen glycol
cần thêm vào 10 lít nước để
thu được một dung dịch có nhiệt
độ đông đặc là -23,3°C. Biết M etylen
glycol = 62,1 . Khối lượng riêng
của nước 1g/ml, hằng số nghiệm
đông của nước 1,86°C.kg/mol
Giải

Ví dụ 5.13b. hòa tan 0,546g
thyroxin (một loại hocmon động vật) vào
15,0g benzen. Dung dịch thu được có độ
hạ nhiệt độ đông đặc là
0,2400C. xác định phân tử lượng
của thyroxin.
Giải
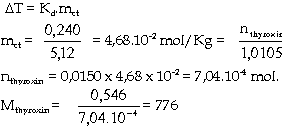
d). Áp suất thẩm
thấu
Ta xét thí nghiệm sau đây:
một ống thủy tinh hình chữ U được
ngăn cách bởi một màng bán thẩm ở
giữa (màng bán thẩm là một loại màng ngăn
có tính chất đặc biệt là chỉ cho các
phân tử dung môi thấm qua nhưng không cho các
phân tử chất tan thấm qua). Cho vào hai bên
ống thể tích bằng nhau của dung môi tinh
chất và dung dịch chứa chất tan. Sau
một thời gian thể tích của dung dịch
tăng còn thể tích của dung môi tinh chất
giảm. Quá trình chuyển dung môi tinh chất sang
dung dịch thông qua màng bán thẩm được
gọi sự thẩm thấu. Ðến một lúc
nào đó mực chất lỏng bên phần
ống đựng dung dịch không dâng cao lên
nữa, quá trình thẩm thấu đạt đến
cân bằng. Mực chất lỏng trong ống
đựng dung dịch cao hơn trong phần
ống đựng dung môi tinh chất, điều
này có ý nghĩa là áp suất tĩnh của dung
dịch lớn hơn của dung môi tinh chất.
Phần áp suất chênh lệch được
gọi là áp suất thẩm thấu.

Hình 5.7. Thí
nghiệm xác định áp suất thẩm
thấu
Chúng ta có thể xét một thí
nghiệm khác như sau: chúng ta cũng bố trí
thí nghiệm tương tự thí nghiệm trên,
và có thể ngăn chặn sự thẩm
thấu bằng cách áp đặt lên dung dịch
một áp suất xác định nào đó. Aïp
suất cần áp đặt lên dung dịch để
ngăn chặn sự thẩm thấu phải
bằng với áp suất thẩm thấu.
Khi 2 chất lỏng tiếp xúc
nhau qua màng bán thẩm, có sự chuyển các phân
tử dung môi từ dung môi tinh chất sang dung
dịch và ngược lại. Do trong dung dịch
có xảy ra sự tương tác giữa các phân
tử chất tan và dung môi nên tốc độ
chuyển các phân tử dung môi từ dung dịch
vào dung môi tinh chất sẽ nhỏ hơn tốc
độ của quá trình ngược lại.
Kết quả là số phân tử dung môi sẽ
chuyển vào dung dịch nhiều hơn, làm tăng
thể tích dung dịch. Sự gia tăng thể tích
dung dịch, sẽ tạo nên một áp suất có
tác động làm tăng vận tốc của quá
trình chuyển các phân tử dung môi từ dung
dịch trở lại dung môi tinh chất. Khi
vận tốc của hai quá trình này bằng nhau,
hệ đạt cân bằng và thể tích dung
dịch không gia tăng được nữa.
Từ điều này cho thấy áp suất
thẩm thấu cũng phụ thuộc vào
nồng độ chất tan trong dung dịch. Ðối
với các dung dịch loãng mối liên hệ
đó được biểu diễn bằng phương
trình:

Áp suất thẩm thấu cũng
được sử dụng để xác định
phân tử lượng của chất tan và
được dùng nhiều hơn các phương
pháp khác bởi vì chỉ cần một nồng
độ nhỏ của chất tan cũng tạo
nên được một áp suất thẩm
thấu có giá trị đáng kể.
Ví dụ 5.14. hòa tan
1,00.10-3 g một protein vào nước
và chỉnh đến thể tích 1ml.
Dung dịch thu được có áp suất
thẩm thấu là 1,12mmHg ở 250C, tính phân
tử lượng của protein.
Giải:
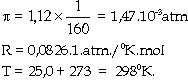

Quá trình thẩm thấu tương
tự được nghiên cứu thấy xảy
ra ở thành tế bào của thực vật và
động vật, nhưng trong trường
hợp này màng bán thẩm cho phép các phân tử
dung môi, các ion và các phân tử chất tan có kích
thước nhỏ thấm qua. Một trong
những ứng dụng quan trọng của sự
thẩm thấu là tạo ra máy lọc máu cho
những bệnh nhân bị bệnh thận. Máu
được cho chảy qua một ống làm
bằng cellophane, đóng vai trò màng bán thẩm,
ống được đặt trong dung dịch
rửa (dialyzing). Dung dịch này chứa các ion cũng
như chứa các chất tan có nồng độ
bằng nồng độ của chúng trong máu, do
sự thẩm thấu các chất thảy sẽ
thấm qua màng đi vào dung dịch và do đó máu
được lọc sạch. Dung dịch có áp
suất thẩm thấu như nhau gọi là dung
dịch đẳng trương. Các chất
lỏng bơm vào máu phải đẳng trương
với chất lỏng trong máu.
Nếu tế bào được
ngâm vào dung dịch ưu trương, nghĩa là
dung dịch có áp suất thẩm thấu lớn hơn
chất lỏng trong tế bào, thì tế bào
sẽ bị co lại do sự mất nước.
Ngược lại, nếu tế bào được
ngâm vào dung dịch nhược trương,
tức dung dịch có áp suất thẩm thấu
nhỏ hơn chất lỏng của tế bào,
tế bào sẽ bị trương phồng và
vỡ ra do sự thâm nhập của nước.
Khi ướp thịt, cá bằng muối, chúng ta
đã tạo ra một dung dịch ưu trương
so với dung dịch trong tế bào vi khuẩn do
đó xảy ra quá trình loại nước
khỏi các tế bào của vi khuẩn làm vi
khuẩn bị co rút lại và chết, nên chúng
ta có thể dùng muối để bảo quản
thịt, cá...
Bây giờ nếu chúng ta cho nước
tinh chất tiếp xúc với dung dịch nước
muối thông qua một màng bán thẩm và tác
động lên dung dịch nước muối
một áp suất lớn hơn áp suất
thẩm thấu của dung dịch nước
muối thì sẽ xảy ra quá trình thẩm
thấu ngược nghĩa là nước sẽ
chuyển từ dung dịch vào nước tinh
chất. Ưïng dụng này có ý nghĩa thực
tiễn lớn. Các máy khử muối xách tay
ứng dụng nguyên tắc trên cho phép lọc
được 5 lít nước từ nước
biển trong 1 giờ, nghĩa là có thể cứu
sống 25 người.
Các phương trình thu
được trên đây chỉ áp dụng
được cho các chất tan không phân ly khi hòa
tan vào dung môi. Trong trường hợp chất tan
phân ly, tức dung dịch thu được là
dung dịch điện ly, để áp dụng
được cần phải có sự hiệu
chỉnh bằng cách thêm một hệ số thích
hợp i, được gọi là hệ số
Vant Hoff.

Hệ số i tính theo lý
thuyết cho một chất là tổng số mol
ion mà 1 mol chất tan có thể phân ly ra, hay nói cách
khác là số ion ứng với công thức
của chất. Ví dụ NaCl có i =2, K2SO4
có i = 3. Nhưng thực tế giá trị i xác
định được bằng thực
nghiệm thường nhỏ hơn giá trị i tính
được bằng lý thuyết. Ðiều này
cho thấy rằng trong dung dịch thực sự
không phải chất tan hoàn toàn phân ly thành các
ion riêng lẻ, độc lập mà sẽ một
phần tồn tại dưới dạng cặp
ion. Ðối với các dung dịch càng loãng thì giá
trị i càng gần với giá trị lý
thuyết. Ðối với các chất tan tạo ion
có điện tích lớn thì giá trị i càng khác
biệt đáng kể so với lý thuyết. Ðiều
này nói lên rằng các dung dịch có ion mang điện
tích lớn, sự hình thành các cặp ion xảy
ra mạnh.
Các phương trình áp
dụng cho dung dịch điện ly cũng có
dạng tương tự như các phương
trình đã trình bày nhưng được bổ
sung thêm hệ số Vant Hoff.
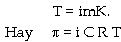
Bảng 5.6. Bảng giá
trị i của một số chất điện
ly khác nhau
tính theo lý thuyết và thực nghiệm (0,05m)
|
Chất
điện ly
|
i lý
thuyết
|
i thực
nghiệm
|
|
NaCl
MgCl2
MgSO4
FeCl3
HCl
Ðường
|
2
3,0
2,0
4,0
2,0
1,0
|
1,9
2,7
1,3
3,4
1,9
1,0
|
a). Khái niệm và phân
loại hệ keo
Các chất tồn tại dưới
dạng các hạt có kích thước khác nhau.
Một số hạt như hạt cát có thể
nhìn thấy bằng mắt thường; một
số khác như các tế bào vi khuẩn không
thể nhìn thấy bằng mắt thường nhưng
có thể quan sát thấy nhờ kính hiển vi
quang học; với các kính hiển vi chuyên
dụng hiện đại có thể phát hiện
được cả nguyên tử.
Người ta định nghĩa
Các hạt có kích thước hơn phân tử và
ion nhưng không đủ lớn
để có thể quan sát được
bằng kính hiển vi quang học được
gọi là các hạt keo.
Hạt keo là một hệ
phức tạp tạo nên bởi một số lượng
lớn khoảng từ 103 đến
105 nguyên tử, có khối lượng
khoảng 104 đến 109
đơn vị nguyên tử, với kích thước
từ 10-5 đến 10-7
cm.
Hạt keo có thể là
chất vô cơ hay hữu cơ. Hầu như
tất cả các chất đều có thể
tồn tại ở dạng keo.
Một hệ keo luôn luôn bao
gồm các hạt keo gọi là chất phân tán và
một chất làm môi trường phân tán. Môi trường
phân tán quan trọng thường gặp là nước
và không khí.
b). Tính chất của
hệ keo
Các hệ keo có tính chất tương
tự như dung dịch. Các hạt keo không tách
ra khỏi hệ như các hạt có kích thước
lớn khác, và có thể xuyên qua được
giấy lọc. Tuy nhiên tốc độ
khuếch tán của các hạt keo trong hệ
chậm hơn tốc độ khuếch tán
của các hạt trong dung dịch như phân
tử và ion.
Sự tán xạ ánh sáng cũng
là một thuộc tính quan trọng của hệ
keo. Khi chiếu ánh sáng đi qua một hệ keo
ta có thể quan sát đường đi của
chùm sáng từ mặt bên thẳng góc với phương
truyền của chùm sáng. Ðây là hiệu ứng
Tyndall được dùng để phân biệt
hệ keo với dung dịch.
Ðộ tăng nhiệt độ
sôi, độ hạ nhiệt độ đông
đặc, độ giảm áp suất hơi và
áp suất thẩm thấu cũng phụ thuộc
vào các hạt keo có trong hệ.
Do kích thước nhỏ nên
các hạt keo có tỷ lệ bề mặt
lớn so với thể tích của hạt keo nên
các hạt keo có khả năng hoạt động
bề mặt lớn, chúng có khả năng
hấp thụ các phân tử và ion có mặt trong
hệ.
c). Phân loại hệ keo
Một phương pháp phân
loại các hệ keo rất thường
được sử dụng là dựa trên
trạng thái vật lý của hạt keo và môi trường
phân tán. Bảng 5.7 trình bày cách phân loại
hệ keo theo phương pháp này.
Một phương pháp quan
trọng khác để phân loại hệ keo là
dựa vào hình dạng của hạt keo. Dạng
không gian 3 chiều giống như quả bóng,
dạng không gian hai chiều giống như
tấm phim, dạng không gian một chiều như
sợi chỉ. Hình dạng khác nhau này làm cho
việc phân loại các hạt keo chiều dài
hoặc đường kính rất khó khăn.
Bảng 5.7. Phân loại
hệ keo
|
Ví dụ
|
Môi trường
phân tán
|
Chất phân tán
|
Loại
hệ
|
|
Sương mù
|
Khí
|
Lỏng
|
|
|
Khói
|
Khí
|
Rắn
|
aerosol rắn
|
|
Sữa
|
Lỏng
|
Lỏng
|
Nhũ tương
|
|
Sơn
|
Lỏng
|
Rắn
|
Dung dịch keo
|
|
Hợp kim
|
Rắn
|
Rắn
|
Dung dịch keo rắn
|
|
Kem
|
Lỏng
|
Khí
|
Bọt
|
Các tính chất cơ học
của hạt keo phụ thuộc chủ yếu vào
hình dạng hạt keo: ví dụ hạt keo có
dạng hình cầu sẽ có độ nhớt
nhỏ hơn các hạt keo có dạng hình
sợi.
Ngoài ra người ta còn phân
biệt hệ keo dựa trên tính kỵ nước
hay ưa nước.
d). Cấu tạo hạt keo

Trung tâm của hạt keo có
thể là tinh thể ion rất nhỏ, hoặc có
thể là một nhóm phân tử, hoặc chỉ có
thể là một phân tử kích thước
lớn. Chúng hấp thụ một lớp ion có cùng
điện tích từ môi trường, lớp ion
này đến lượt nó lại hấp
thụ một lớp ion có điện tích trái
dấu bao quanh, kết quả dẫn đến các
hạt keo phần bên ngoài đều có cùng điện
tích. Do có cùng điện tích nên các hạt keo
sẽ đẩy nhau, không thể kết hợp
lại được thành hạt có kích thước
lớn tách ra khỏi hệ. Chính lực đẩy
tĩnh điện này làm cho hệ keo bền trong
một khoảng thời gian dài.
e). Phương pháp điều
chế keo
Chúng ta có thể tạo ra
hệ keo bằng cách tạo ra các hạt có kích
thước hạt keo và phân tán chúng vào môi trường.
Hạt có kích thước hạt keo có thể
được tạo thành bằng hai phương
pháp:
- Phương pháp phân tán:
bằng cách phân chia các hạt có kích thước
lớn thành các hạt có kích thước hạt
keo, ví dụ nghiền mịn bột màu.
- Phương pháp cô đặc:
kết hợp các hạt có kích thước
nhỏ với nhau tạo thành các hạt có kích
thước hạt keo, ví dụ: mây được
hình thành khi có lượng lớn các phân tử
nước đông tụ lại, chúng sẽ
tạo ra các giọt nước rất nhỏ.
Một số ít chất
rắn khi cho vào nước, chúng tự phân tán
một cách tự nhiên vào nước, và hình thành
hệ keo-Gélatin, hồ, bột thuộc loại này
và quá trình này được gọi là sự
pepti hóa. Các hạt đó, bản thân chúng đã
có kích thước của hạt keo, nước
chỉ làm nhiệm vụ phân tán chúng- Sữa
được điều chế với kích thước
của hạt keo bằng cách làm khô các hạt nước
từ các tia sửa.
Một hệ nhũ tương
được điều chế bằng cách
lắc chung hai chất lỏng không có khả năng
tan lẫn vào nhau. Sự lắc mạnh làm vỡ
chất lỏng thành các hạt nhỏ có kích thước
hạt keo và phân tán chúng vào nhau. Tuy nhiên các
hạt chất lỏng của chất phân tán thường
có khuynh hướng tái hợp với nhau, hình thành
giọt lớn hơn và sau đó tách thành hai
lớp chất lỏng riêng biệt-do đó để
làm cho các hệ keo này bền vững phải
sử dụng các chất nhũ hóa-ví dụ:
sửa là một hệ nhũ bền của các
hạt mỡ trong nước với chất nhũ
hóa là casein. Nước sốt là hệ nhũ
của dầu trong giấm với chất nhũ hóa
là lòng đỏ trứng. Các chất dầu loang
trên biển rất khó làm sạch do xảy ra
sự tạo nhũ giữa dầu và nước.
Các chất bẩn, dầu
mỡ bám trên vải, sợi bị hút bởi
mạch hidrocacbon của xà phòng hay bột giặt
hình thành các hạt keo lơ lững trong nước
và do đó dễ dàng bị rửa sạch
bởi nước
Phương pháp cô đặc
thường đi kèm với các phản ứng hóa
học. Ví dụ keo hidroxit sắt (III) taọ ra
bằng cách cho dung dịch muối sắt (III)
đậm đặc vào nước nóng, dung
dịch nhũ vàng có thể tạo ra bằng cách
khử Au 3+ trong dung dịch rất loãng
bởi aldehyt.
f) Sự keo tụ
Ðể phá hủy hệ keo, còn gọi là
sự keo tụ, chúng ta có thể dùng cách đun
nóng hoặc thêm các chất điện ly. Sự
đun nóng làm tăng tốc độ của các
hạt, làm cho chúng có đủ năng lượng
để vượt ra lớp rào ion bên ngoài và
do đó có thể kết hợp lại với
nhau. Quá trình này được lập lại
nhiều lần nên kích thướt hạt sẽ
lớn lên và lắng xuống được.
Sự thêm chất điện ly vào có tác
dụng trung hòa lớp ion bị hấp thụ bên
ngoài hạt keo và do đó các hạt keo có
thể kết hợp lại với nhau để
lắng xuống. Sự keo tụ dẫn đến
sự hình thành các tam giác châu ở cửa sông.
Khi gặp biển, nồng độ chất điện
ly cao trong nước biển làm cho các hạt keo
trong nước sông đông tụ hình thành các
tam giác châu. Sự loại bỏ bồ hóng
khỏi khói là một ví dụ khác về sự
keo tụ. Khí từ các nhà máy được
dẫn qua một hệ tĩnh điện, các
hạt bụi mồ hóng sẽ bị giữ
lại do keo tụ, điều này giúp làm
sạch không khí ở các thành phố công
nghiệp nặng.


|