|
13.1. YÊU CẦU DINH DƯỠNG CỦA VI SINH VẬT13.1.1. Thành phần hoá học của tế bào vi sinh vậtCơ sở vật chất cấu tạo nên tế bào vi sinh vật là các nguyên tố hoá học. Căn cứ vào mức độ yêu cầu của vi sinh vật đối với các nguyên tố này mà người ta chia ra thành các nguyên tố đa lượng và các nguyên tố vi lượng. Các nguyên tố chủ yếu bao gồm: C, H, O, N, P, S, K, Mg, Ca và Fe. Trong số này có 6 loại chủ yếu (chiếm đến 97% trọng lượng khô của tế bào vi sinh vật), đó là C, H, O, N, P và S. Các nguyên tố vi lượng thường là Zn, Mn, Na, Cl, Mo, Se, Co, Cu, W, Br và B. Tỷ lệ các nguyên tố hoá học tham gia cấu tạo tế bào vi sinh vật là không giống nhau ở các nhóm vi sinh vật khác nhau. Ví dụ nấm men, nấm sợi và vi khuẩn có lượng chứa trung bình của 6 nguyên tố chủ yếu là không giống nhau (bảng 13.1): Bảng 13.1: Lượng chứa trung bình các loại nguyên tố chủ yếu trong tế bào một số nhóm vi sinh vật (% trọng lượng khô)
Theo các tài liệu của Tempest (1969), Pirt (1975) và Herbert (1976) thì thành phần trung bình của các nguyên tố tạo nên tế bào vi sinh vật nói chung là như sau: Bảng 13.2: Thành phần các nguyên tố cấu tạo nên sinh khối tế bào
*Các tế bào bao gồm 70% trọng lượng là nước và 30% là các nguyên liệu khô khác. Mức trung bình này được tính theo sinh trưởng của vi khuẩn Gr(-) trong điều kiện dư thừa chất dinh dưỡng ở nuôi cấy theo mẻ. Vi khuẩn lưu huỳnh (sulfur bacteria), vi khuẩn sắt (iron bacteria) và vi khuẩn đại dương (marine bacteria) có lượng chứa các nguyên tố S, Fe, Na, Cl nhiều hơn so với các nhóm vi khuẩn khác. Tảo Silic (diatom) có chứa lượng SiO2 khá cao trong thành tế bào. Thành phần các nguyên tố hoá học còn thay đổi trong một phạm vi nhất định tuỳ thuộc vào tuổi nuôi cấy và điều kiện nuôi cấy. Khi nuôi cấy trên các môi trường có nguồn N phong phú thì lượng chứa N trong tế bào sẽ cao hơn so với khi nuôi cấy trên các môi trường nghèo nguồn N. Các nguyên tố hoá học chủ yếu tồn tại trong tế bào vi sinh vật dưới dạng chất hữu cơ, chất vô cơ và nước. Chất hữu cơ thường bao gồm protein, carbon hydrat, lipid, acid nucleic, vitamin và các sản phẩm phân giải của chúng cũng như các chất trao đổi chất. Để phân tích các thành phần hữu cơ trong tế bào thường sử dụng hai phương pháp: một là, dùng phương pháp hoá học để trực tiếp chiết rút từng thành phần hữu cơ trong tế bào, sau đó tiến hành phân tích định tính và định lượng. Hai là, phá thành tế bào, thu nhận các thành phần kết cấu hiển vi rồi phân tích thành phần hoá học của từng kết cấu đó. Chất vô cơ thường đứng riêng rẽ dưới dạng muối vô cơ hoặc kết hợp với chất hữu cơ. Khi phân tích thành phần vô cơ trong tế bào người ta thường phân tích tro sau khi đã nung tế bào ở nhiệt độ 5500 C, chất vô cơ thu được dưới dạng các oxit vô cơ được gọi là thành phần tro. Dùng phương pháp phân tích vô cơ có thể định tính hay định lượng từng nguyên tố vô cơ. Bảng 13.3:Thành phần hóa học của tế bào vi khuẩn (theo F.C.Neidhardt et al.,1996)
Chú thích:(1) -Khối lượng khô của tế bào vi khuần Escherichia coli đang sinh trưởng là khoảng 2.8 x 10-13g. (2) - Giả thiết Peptidoglycan và Glycogen là 2 thành phần chủ yếu. (3) - Tế bào chứa vài loại phospholipid, do tính đa dạng của thành phần acid béo giữa các chi vi khuẩn khác nhau và do ảnh hưởng của điều kiện sinh trưởng mà có nhiều hình thức tồn tại của mỗi loại phospholipid. Nước là thành phần không thể thiếu để duy trì hoạt động sống bình thường của tế bào. Nước thường chiếm đến 70-90% trọng lượng tế bào. Độ chênh lệch giữa trọng lượng tươi và trọng lượng khô chính là lượng nước trong tế bào, thường biểu thị bằng tỷ lệ % tính theo công thức sau đây: (Trọng lượng tươi - Trọng lượng khô) / Trọng lượng tươi x 100%. Đơn vị trọng lượng tế bào trong dịch nuôi cấy thường được biểu thị bằng đơn vị g/l hay mg/ml. Phương pháp nung khô tế bào ở nhiệt độ 5500C thường làm phân giải một số hợp chất của tế bào vì vậy khi tính trọng lượng khô của tế bào nên dùng phương pháp sấy khô ở 1050C hay làm khô ở nhiệt độ không cao trong chân không, hoặc làm khô nhanh nhờ tia hồng ngoại... 13.1.2. Các chất dinh dưỡng và chức năng sinh lýVi sinh vật chủ yếu thu nhận được chất dinh dưỡng từ môi trường bên ngoài. Căn cứ vào chức năng sinh lý khác nhau trong tế bào mà người ta thường chia các chất dinh dưỡng thành 5 nhóm lớn: 1) Nguồn carbon (source of carbon)Là nguồn vật chất cung cấp C trong quá trình sinh trưởng của vi sinh vật. Trong tế bào nguồn C trải qua một loạt quá trình biến hoá hoá học phức tạp sẽ biến thành vật chất của bản thân tế bào và các sản phẩm trao đổi chất. C có thể chiếm đến khoảng một nửa trọng lượng khô của tế bào. Đồng thời hầu hết các nguồn C trong các quá trình phản ứng sinh hoá còn sinh ra trong tế bào nguồn năng lượng cần thiết cho hoạt động sống của vi sinh vật. Một số vi sinh vật dùng CO2 làm nguồn C duy nhất hay chủ yếu để sinh trưởng, khi đó nguồn C không phải là nguồn sinh năng lượng. Vi sinh vật sử dụng một cách chọn lọc các nguồn C. Đường nói chung là nguồn C và nguồn năng lượng tốt cho vi sinh vật. Nhưng tuỳ từng loại đường mà vi sinh vật có những khả năng sử dụng khác nhau. Ví dụ trong môi trường chứa glucose và galactose thì vi khuẩn Escherichia coli sử dụng trước glucose (gọi là nguồn C tốc hiệu) còn galactose được sử dụng sau (gọi là nguồn C trì hiệu). Hiện nay trong các cơ sở lên men công nghiệp người ta sử dụng nguồn C chủ yếu là glucose, saccharose, rỉ đường (phụ phẩm của nhà máy đường) tinh bột (bột ngô, bột khoai sắn...), cám gạo, các nguồn cellulose tự nhiên hay dịch thuỷ phân cellulose. Năng lực đồng hoá các nguồn C ở các vi sinh vật khác nhau là không giống nhau. Có loài có khả năng sử dụng rộng rãi nhiều nguồn C khác nhau, nhưng có loài khả năng này rất chọn lọc. Chẳng hạn vi khuẩn Pseudomonas có thể đồng hoá được tới trên 90 loại hợp chất C, nhưng các vi khuẩn thuộc nhóm dinh dưỡng methyl (methylotrophs) thì chỉ đồng hoá được các hợp chất 1C như methanol, methane... Nguồn C chủ yếu được vi sinh vật sử dụng gồm có đường, acid hữu cơ, rượu, lipid, hydrocarbon, CO2, carbonat... (Bảng 13.4) Bảng 13.4: Nguồn C được vi sinh vật sử dụng
Hình 13.1: Sản lượng sinh trưởng tối ưu khi vi sinh vật dị dưỡng sử dụng các nguồn C khác nhau Nguồn carbon thường được sử dụng trong công nghiệp lên men là rỉ đường (molasses). Sự khác nhau giữa rỉ đường mía và rỉ đường củ cải được thấy rõ trong bảng 13.5 Bảng 13.5: Thành phần hóa học của rỉ đường củ cải và rỉ đường mía
Tỷ lệ các
nguyên tố trong các hợp chất cao phân tử ở vi sinh vật có thể thấy rõ
trong bảng sau đây: Bảng 13.6: Tỷ
lệ các nguyên tố trong các cao phân tử ở tế bào vi sinh vật
*PHB= Poly- β- hydroxy butyrate 2) Nguồn N (source of nitrogen) Nguồn N là nguồn cung cấp N cho vi sinh vật để tổng hợp nên các hợp chất chứa N trong tế bào. Thường không là nguồn năng lượng, chỉ một số ít vi sinh vật tự dưỡng (thuộc nhóm ammon hoá-ammonification, nhóm nitrate hoá- nitrification) dùng muối ammone, muối nitrate làm nguồn năng lượng. Trong điều kiện thiếu nguồn C một số vi sinh vật kỵ khí trong điều kiện không có oxy có thể sử dụng một số aminoacid làm nguồn năng lượng. Nguồn N thường được vi sinh vật sử dụng là protein và các sản phẩm phân huỷ của protein ( peptone, peptide, aminoacid...), muối ammone, nitrate, N phân tử (N2), purine, pyrimidine, urea, amine, amide, cyanide...(bảng 13.7) Bảng 13.7: Nguồn N được vi sinh vật sử dụng
Nguồn N thường được sử dụng để nuôi cấy vi sinh vật gồm có pepton, bột cá, bột nhộng tằm, bột đậu tương, bột khô lạc, cao ngô, cao thịt, cao nấm men... Vi sinh vật sử dụng chọn lọc đối với nguồn N. Chẳng hạn xạ khuẩn sản sinh terramycin sử dụng cao ngô với tốc độ nhanh hơn so với sử dụng khô đậu tương hay khô lạc, bởi vì nguồn N trong cao ngô là các sản phẩm phân giải dễ hấp thu của protein. Cao ngô được coi là nguồn N tốc hiệu, còn khô dầu được coi là nguồn N trì hiệu. Loại N tốc hiệu là có lợi cho sự sinh trưởng của vi sinh vật, còn loại trì hiệu lại có lợi cho sự hình thành các sản phẩm trao đổi chất. Khi sản xuất terramycin chẳng hạn, người ta phối hợp sử dụng cao ngô và khô dầu theo một tỷ lệ nhất định để phối hợp giữa giai đoạn sinh trưởng tạo sinh khối và giai đoạn sinh tổng hợp các sản phẩm trao đổi chất, nhằm mục tiêu là nâng cao sản lượng terramycin. Năng lực hấp thu muối ammone và nitrate ở vi sinh vật là khá mạnh. Ion NH4+ sau khi được tế bào hấp thu có thể được trực tiếp sử dụng, do đó các nguồn muối ammone được coi là nguồn N tốc hiệu. Còn nitrate sau khi được hấp thụ cần khử thành NH4+ rồi mới được vi sinh vật sử dụng. Đa số các vi khuẩn hoại sinh (saprophyte), vi khuẩn đường ruột, vi sinh vật gây bệnh ở người, động vật, thực vật...đều có thể dùng muối ammone, muối nitrate làm nguồn N. Chẳng hạn các vi khuẩn Escherichia coli, Enterobacter aerogenes, Bacillus subtilis, Pseudomonas aeruginosa...đều có thể sử dụng nguồn (NH4)2SO4 và NH4NO3 làm nguồn N; xạ khuẩn có thể sử dụng KNO3 làm nguồn N; nấm sợi có thể sử dụng KNO3 làm nguồn N. Lúc dùng các muối như (NH4)2SO4 để làm nguồn N nuôi cấy vi sinh vật cần chú ý là sau khi vi sinh vật hấp thu NH4+ thì sẽ làm hạ thấp pH của môi trường. Người ta gọi đó là những muối có tính sinh lý acid. Ngược lại khi dùng các muối nitrate (như KNO3) sau khi vi sinh vật hấp thu NO3- thì sẽ làm nâng cao pH của môi trường. Người ta gọi đó là các muối có tính sinh lý kiềm. Để làm cho pH trong các môi trường nuôi cấy vi sinh vật ít bị biến động người ta bổ sung thêm các chất có tính đệm (buffer substance). 3) Nguồn muối vô cơ (source of inorganic salt) Các muối vô cơ là nguồn chất dinh dưỡng không thể thiếu đối với sự sinh trưởng của vi sinh vật. Chúng có các chức năng sinh lý chủ yếu là: tham gia vào thành phần của các trung tâm hoạt tính ở các enzyme của vi sinh vật, duy trì tính ổn định của kết cấu cá đại phân tử và tế bào, điều tiết và duy trì cân bằng áp suất thẩm thấu của tế bào, khống chế điện thế oxy hoá khử của tế bào và là nguồn vật chất sinh năng lượng đối với một số loài vi sinh vật (bảng 13.8). Bảng 13.8: Muối vô cơ và chức năng sinh lý của chúng
Trong quá trình sinh trưởng vi sinh vật còn cần tới một số nguyên tố vi lượng. Những nguyên tố này cũng có vai trò quan trọng mặc dầu chỉ cần với số lượng rất nhỏ, khoảng 10-8-10-6 mol/ L môi trường nuôi cấy. Nguyên tố vi lượng tham gia vào thành phần enzyme và làm hoạt hoá enzyme. (Bảng 13.9) Bảng 13.9: Tác dụng sinh lý của nguyên tố vi lượng
Nếu thiếu nguyên tố vi lượng trong quá trình sinh trưởng thì hoạt tính sinh lý của vi sinh vật bị giảm sút, thậm chí ngừng sinh trưởng. Do nhu cầu dinh dưỡng của vi sinh vật là không giống nhau cho nên khái niệm về nguyên tố vi lượng chi có ý nghĩa tương đối. Vi sinh vật thường tiếp nhận nguyên tố vi lượng từ các chất dinh dưỡng hữu cơ thiên nhiên, các hoá chất vô cơ, nước máy hay ngay từ trong các dụng cụ nuôi cấy bằng thuỷ tinh. Chỉ trong những trường hợp đặc biệt mới cần bổ sung nguyên tố vi lượng vào môi trường nuôi cáy vi sinh vật. Vì nhiều nguyên tố vi lượng là kim loại nặng cho nên nếu dư thừa sẽ gây hại cho vi sinh vật. Khi cần bổ sung thêm nguyên tô vi lượng vào môi trường cần lưu ý khống chế chính xác liều lượng. 4) Nhân tố sinh trưởngNhân tố sinh trưởng (growth factor) là những hợp chất hữu cơ mà có những vi sinh vật cần thiết để sinh trưởng tuy với số lượng rất nhỏ và không tự tổng hợp đủ so với nhu cầu. Các vi sinh vật khác nhau có những yêu cầu không giống nhau về chủng loại và liều lượng của các nhân tố sinh trưởng. Sau đây là một số ví dụ (bảng 13.10). Bảng 13.10: Các nhân tố sinh trưởng cần thiết dối với một số loài vi sinh vật
Chú thích: 1 mg= 10-6g; 1ng= 10-9g Vi sinh vật tự dưỡng và một số vi sinh vật dị dưỡng (như Escherichia coli) thậm chí có thể sinh trưởng mà không cần bất kỳ nhân tố sinh trưởng nào. Mặt khác, cùng một loài vi sinh vật nhưng nhu cầu đối với nhân tố sinh trưởng cũng thay đổi tuỳ theo điều kiện môi trường. Ví dụ Mucor rouxii khi sinh trưởng trong điều kiện kỵ khí thì cần thiamin (B1) và biotin (H), nhưng trong điều kiện hiếu khí thì lại tự tổng hợp được các vitamin này. Có trường hợp chưa giải thích được bản chất của nhu cầu về nhân tố sinh trưởng ở một số loài vi sinh vật. Thông thường bổ sung vào môi trường các chất hữu cơ như cao nấm men, cao thịt, dịch đun động thực vật (nhộng, giá đỗ…) là có thể đáp ứng được nhu cầu về nhân tố sinh trưởng. Căn cứ vào sự khác nhau về cấu trúc hoá học và chức năng sinh lý của các nhân tố sinh trưởng người ta chia nhân tố sinh trưởng thành các nhóm vitamin, aminoacid, purine và pyrimidine. Vitamin là nhân tố sinh trưởng được tìm thấy bản chất hoá học sớm nhất. Hiện nay người ta đã phát hiện được nhiều loại vitamin có tác dụng là nhân tố sinh trưởng. Một số vi sinh vật có thể tự tổng hợp được vitamin, nhưng nhiều loại khác lại cần được cung cấp vitamin trong môi trường dinh dưỡng thì mới sinh trưởng được. Vitamin chủ yếu là coenzyme hay cofactor của các enzyme tham gia vào quá trình trao đổi chất. Một số vi sinh vật không tự tổng hợp được những aminoacid nào đó, cần bổ sung vào môi trường các aminoacid đó hay bổ sung peptide chuỗi ngắn. Chẳng hạn vi khuẩn Leuconostoc mesenteroides cần tới 17 loại aminoacid mới sinh trưởng đươc. Một số vi khuẩn cần cung cấp D-alanin để tổng hợp thành tế bào. Purine và pyrimidine chủ yếu được dùng làm coenzyme hay cofactor của các enzyme cần thiết cho quá trình tổng hợp nucleoside, nucleotide và acid nucleic. Bảng 13.11: Chức năng của một số vitamin thông thường đối với vi sinh vật
Chú thích: B-Vi khuẩn; F-Vi nấm; A-Vi tảo; P-Động vật nguyên sinh 5) Nước Nước là thành phần không thể thiếu để vi sinh vật có thể sinh trưởng. Chức năng sinh lý của nước trong tế bào là: - Hoà tan và chuyển vận các chất, hỗ trợ cho việc hấp thu chất dinh dưỡng, giải phóng các sản phẩm trao đổi chất. - Tham gia vào hàng loạt các phản ứng hóa học trong tế bào. - Duy trì cấu hình thiên nhiên ổn định của các đại phân tử như protein, acid nucleic... - Là thể dẫn nhiệt tốt, hấp thu tốt nhiệt lượng sinh ra trong quá trình trao đổi chất và khuếch tán kịp thời ra bên ngoài để duy trì sự ổn định của nhiệt độ bên trong tế bào. - Duy trì hình thái bình thường của tế bào. - Thông qua quá trình thuỷ phân hay khử nước để khống chế kết cấu của tế bào (enzyme, vi ống, tiên mao...) và sự tháo lắp ở virút. Tính hữu hiệu của nước đối với sự sinh trưởng của vi sinh vật thường được biểu thị bằng độ hoạt động (hoạt độ) của nước (water activity, aw). Đó là tỷ lệ giữa áp lực hơi nước của dung dịch trong những điều kiện nhiệt độ và áp lực nhất định với áp lực của hơi nước thuần khiết trong cùng những điều kiện như vậy: aw = p w / pw0 Ở đây Pw là áp lực hơi nước của dung dịch, còn aw0 là áp lực của hơi nước thuần khiết. Pw0 của nước thuần khiết là 1.0. Dung dịch càng chứa nhiều dung chất (chất hoà tan) thì aw càng nhỏ. Vi sinh vật thường sinh trưởng trong điều kiện có aw trong khoảng 0,6-0,99. Đối với một số loài vi sinh vật khi aw quá thấp thì tốc độ sinh trưởng và tổng sinh khối giảm. Các vi sinh vật khác nhau có aw thích hợp không giống nhau (bảng 13.12) Bảng 13.12: aw
thích hợp nhất cho sinh trưởng ở một số nhóm vi sinh vật
Nhìn chung aw thích hợp nhất cho sự sinh trưởng của vi khuẩn cao hơn của nấm men và nấm sợi. Vi sinh vật ưa mặn có aw thích hợp nhất cho sự sinh trưởng là khá thấp. Phần nước có thể tham gia vào các quá trình trao đổi chất của vi sinh vật được gọi là nước tự do. Phần lớn nước tồn tại trong tế bào vi sinh vật là nước tự do. Phần nước liên kết với các hợp chất hữu cơ cao phân tử trong tế bào được gọi là nước liên kết. Nước liên kết mất đi khả năng hoà tan và lưu động. 13.1.4. Khái niệm về sự sinh trưởng trong điều kiện hạn chế các chất dinh dưỡngỞ môi trường nuôi cấy lắc trong phòng thí nghiệm, khi tất cả các chất dinh dưỡng được cung cấp cho sự sinh trưởng của vi sinh vật đã được thiết kế tối ưu thì sự dư thừa xảy ra vào lúc đầu và các tế bào sinh trưởng theo logarit với tốc độ sinh trưởng là lớn nhất. Tuy nhiên, trong mỗi hệ thống môi trường và kỹ thuật nuôi cấy, sự sinh trưởng của vi sinh vật không thể tiếp diễn mãi mà không bị giới hạn trong một khoảng thời gian dài. Một tính toán đơn giản để chứng minh nhận định này là: sau 2 ngày sinh trưởng theo logarit, một tế bào vi sinh vật cứ 20 phút lại nhân đôi một lần sẽ tạo ra xấp xỉ 2 x 1043 tế bào. Giả sử khối lượng trung bình của mỗi tế bào là 10-12 g thì toàn sinh khối tế bào trên sẽ có khối lượng gấp gần 400 lần khối lượng của quả đất. Vì vậy, trong mỗi một thể tích nuôi cấy, sự sinh trưởng luôn luôn sớm bị giới hạn do sự cạn kiệt của một hoặc vài chất dinh dưỡng. Thuật ngữ “các chất dinh dưỡng hạn chế” được sử dụng với rất nhiều ý nghĩa, và thường vẫn bị nhầm lẫn. Các chất dinh dưỡng hạn chế có khả năng ảnh hưởng đến sự sinh trưởng trong các môi trường nuôi cấy vi sinh vật theo hai cách riêng biệt: hóa học và và động học. Sự hạn chế hóa học được định nghĩa là khối lượng lớn nhất sinh khối có thể được tạo ra trong điều kiện giới hạn các chất dinh dưỡng. “Nguyên lý Liebig” bắt nguồn từ các nghiên cứu về sự màu mỡ trong nông nghiệp của Justus von Liebig vào năm 1840. Trong nghiên cứu này ông tìm ra rằng hàm lượng của một chất dinh dưỡng nào đó sẽ quyết định đến năng suất mùa màng, miễn là tất cả các chất dinh dưỡng khác đã có mặt một cách dư thừa (phương trình 1). Giới hạn động học xuất hiện khi nồng độ các chất dinh dưỡng là thấp (trong phạm vi từ miligram tới microgram trong mỗi lit), sự hạn chế các chất dinh dưỡng sẽ điều khiển tốc độ sinh trưởng riêng của tế bào (μ). Điều khiển động học về tốc độ sinh trưởng thường kéo theo các động lực bão hòa và phương trình Monod (phương trình 2) được sử dụng để mô tả mối quan hệ giữa nồng độ của các chất dinh dưỡng đối với tốc độ sinh trưởng riêng của tế bào (μ). X = X0 + ( S0 - S) x YX/S (1) μ = μmax x x s / (KS + S) (2) Trong đó S0 là nồng độ ban đầu và s là nồng độ cuối cùng của các chất dinh dưỡng bị hạn chế S; X(X0) là nồng độ sinh khối (ban đầu); là sản lượng sinh khối thu được đối với chất dinh dưỡng S, μmax là tốc độ sinh trưởng riêng lớn nhất, và KS là hằng số ái lực cơ chất Monod. Điều này thể hiện rõ trong hình 13.2 đối với sự sinh trưởng trong hệ thống nuôi cấy kín. Các tế bào ban đầu sinh trưởng không giới hạn cho đến khi sự tiêu thụ các chất dinh dưỡng hạn chế bị hết dần, dẫn đến tốc độ sinh trưởng suy giảm dần, sau đó tốc độ sinh trưởng ngừng hẳn. Đó là lúc đạt đến nồng độ cuối cùng của sinh khối. Trong nuôi cấy liên tục, người bổ sung môi trường một cách liên tục và một lượng môi trường dư thừa được loại bỏ. Tốc độ bổ sung thêm vào của các chất dinh dưỡng bị hạn chế sẽ điều khiển đồng thời cả μ và nồng độ sinh khối trong môi trường nuôi cấy (Pirt, 1975; Kovarova và Egli, 1998).
Hình 13.2: Động học của sự giới hạn sinh trưởng của vi sinh vật trong nuôi cấy đóng do giới hạn nồng độ của chất dinh dưỡng (cơ chất) S. S0 là nồng độ cơ chất ban đầu, s là nồng độ thực của cơ chất, X là nồng độ sinh khối; X0: nồng độ sinh khối ban đầu; Y: sản lượng sinh khối thu được đối với cơ chất S. Trong thực nghiệm, người ta có thể nuôi cấy các tế bào trong các điều kiện đã được biết rõ, nhờ đó các chất dinh dưỡng hạn chế sẽ được xác định. Đối với việc nuôi cấy các vi sinh vật dị dưỡng để nghiên cứu và tạo ra các sản phẩm sinh khối, môi trường được thiết kế phổ biến với nguồn carbon và năng lượng giới hạn, tất cả các chất dinh dưỡng khác được cung cấp dư thừa. Tuy nhiên, trong quá trình công nghệ sinh học, sự giới hạn bởi các chất dinh dưỡng chứ không phải nguồn carbon giữ chức năng điều khiển các trạng thái sinh lý và quá trình trao đổi chất của vi sinh vật. Sự hạn chế các chất dinh dưỡng nào đó thường kích thích hoặc tăng cường sự tạo thành rất nhiều các sản phẩm trao đổi chất và các enzyme của vi sinh vật. Ví dụ, năng suất sẽ được tăng lên trong quá trình lên men tạo chất kháng sinh do sinh trưởng trong môi trường hạn chế photphat, sự sản xuất acid citric trong môi trường có sự hạn chế Fe-, Mn-, hoặc Zn. Còn sự sinh tổng hợp của NAD là được thực hiện trong điều kiện hạn chế Zn-Mn. Việc tích lũy các nguyên liệu dự trữ nội bào PHB hoặc PHA (chất dẻo sinh học-bioplastic) sẽ bị giới hạn bởi nguồn cung cấp hợp chất giàu nitrogen. Rõ ràng là sự sinh trưởng của vi sinh vật được điều khiển thường xuyên không phải chỉ bởi một chất dinh dưỡng mà bởi sự kết hợp của hai hay nhiều chất dinh dưỡng đồng thời (Kovarova và Egli, 1998). 13.1.5. Thiết kế và phân tích môi trường sinh trưởng tối thiểuĐể sinh trưởng và tổng hợp các nguyên liệu tế bào cho bản thân mình, vi sinh vật phải thu nhận các thành phần cấu trúc (hay các tiền chất của chúng) và năng lượng cần thiết từ môi trường sống. Do đó, để nuôi cấy vi sinh vật trong phòng thí nghiệm thì các chất dinh dưỡng phải được cung cấp đầy đủ vào môi trường và các chất dinh dưỡng phải ở dạng mà các vi sinh vật này có thể sử dụng được. Do có sự đa dạng sinh lý của thế giới vi sinh vật mà có vô số các môi trường với thành phần dinh dưỡng khác nhau đã được đưa ra, với mục đích hoặc là làm giàu một cách chọn lọc hoặc là để nuôi cấy một nhóm ví sinh vật đặc thù nào đó (LaPage và cs, 1970; Balows và cs 1992; Atlas, 1997). Tất cả các môi trường này đều chứa các thành phần với các chức năng dinh dưỡng rõ ràng, đặc biệt là cân nhắc về chức năng cấu trúc hoặc sinh năng lượng. Tuy nhiên, hầu hết các nghiên cứu về chất dinh dưỡng được tiến hành định tính chứ không phải định lượng và các chất dinh dưỡng khác nhau được thêm vào nhiều hơn hay ít hơn một cách tùy ý. Ngoài ra, rất nhiều các môi trường nuôi cấy có chứa các thành phần không được biết rõ ràng bởi vì sử dụng các nguyên liệu hữu cơ như ngô, khoai tây,… Trong cùng những điều kiện như: nhiệt độ hoặc pH, tốc độ sinh trưởng riêng lớn nhất của vi sinh vật bị ảnh hưởng bởi sự đa dạng của các chất dinh dưỡng trong môi trường. Điều này được minh họa một cách cụ thể đối với sự sinh trưởng của Salmonella typhimurium (thí nghiệm bởi Schaechter và cs, 1958). Họ đã sử dụng 22 môi trường có thành phần khác nhau và nhận thấy các tốc độ sinh trưởng khác nhau ở các môi trường trong các điều kiện dư thừa các chất dinh dưỡng. Kết quả cho thấy chất lượng các tiền chất đưa vào môi trường khoáng cho phép điều chỉnh tốc độ sinh trưởng một cách rõ ràng nhất.
Trong thiết kế môi trường sinh trưởng, quyết định đầu tiên được đưa ra là chọn lựa nồng độ cao nhất cho phép tạo ra sinh khối (Xmax), và xác định các chất dinh dưỡng giới hạn (theo nguyên lý Liebig). Điển hình, môi trường sinh trưởng cho các vi sinh vật dị dưỡng được thiết kế với nguồn năng lượng - carbon riêng biệt sẽ giới hạn lượng sinh khối được tạo ra, nhưng ngược lại tất cả các chất dinh dưỡng khác (được thêm vào dưới dạng các hợp chất đơn) được cung cấp dư thừa. Dựa vào giá trị X max, có thể tính toán được nồng độ tối thiểu của các nguyên tố khác nhau cần thiết trong môi trường nuôi cấy. Để đảm bảo sự dư thừa của tất cả chất dinh dưỡng không giới hạn trong môi trường thì nồng độ của chúng được nhân với nhân tố dư (FE). Bằng cách này, nồng độ của chất dinh dưỡng đòi hỏi trong môi trường tăng trưởng (Ereq) gấp x lần theo lý thuyết đối với nguồn carbon. YX/E (the individual average elemental growth yield) là sản lượng tăng trưởng trung bình dựa trên từng nguyên tố. Một ví dụ cho việc thiết kế môi trường khi giới hạn nguồn carbon, cho phép tạo sản lượng sinh khối khô đạt 10g/l sinh (bảng 13.13). Cần chú ý rằng, trong môi trường này các thành phần được lựa chọn sao cho có thể thay đổi nồng độ của mỗi nguyên tố (ví dụ có thể thay thể MgCl2 và NaHSO4 bằng MgSO4). Hơn nữa, môi trường này chỉ có tính chất đệm yếu (weakly buffered), do đó cần thiết phải khống chế pH trong suốt quá trình sinh trưởng. Cách thức
này được sử dụng cho việc thiết kế môi trường nuôi cấy các vi sinh vật
hiếu khí với mật độ sinh khối thấp và trung bình. Phức tạp hơn là thiết
kế của môi trường cho nuôi cấy vi sinh vật kỵ khí, trong đó rất nhiều
thành phần của môi trường dễ dàng kết tủa tại thế oxy hóa khử cần thiết,
hoặc mật độ tế bào cao trong đó có chứa các chất hòa tan hoặc vấn đề độc
tính của một số môi trường. Bảng 13.13: Thiết kế môi trường tối thiểu bị giới hạn bời nguồn C cho phép sản lưởng sinh khối khô đạt 10g/l a,b
Nhân tố YX/E được phân tích từ sinh khối khô khi nuôi cấy trong điều kiện không giới hạn tăng trưởng của hệ thống đóng. Đối với carbon, oxy, và hydro, YX/E không thể được tính toán chính xác trực tiếp từ các thành phần cơ bản của tế bào do những thành phần này không chỉ tạo nên sinh khối, mà còn có các chức năng trao đổi chất khác.Ngoài ra, trong bảng không nói đến một số lượng lớn các chất nhận điện tử cần thiết phải được đảm bảo cho quá trình sinh trưởng. Tính chất hóa học của các thành phần trong môi trường sinh trưởng phải được tính đến khi chọn FE. Ví dụ, phần lớn các nguyên tố vi lượng dễ dàng kết tủa trong môi trường sinh trưởng ở pH trung tính hoặc kiềm và do đó giảm bớt khả năng hấp thụ sinh học (khó khăn để xác định). Do đó, chúng được thêm vào nhiều gấp 10 tới 20 lần (Bridson và Brecker, 1970). Trong công nghệ sinh học, quá trình nuôi cấy theo mẻ (batch) và nuôi cấy theo mẻ có bổ sung (fed-batch) được nghiên cứu từ lâu vì rất có lợi khi thiết kế các môi trường chứa tất cả nguyên tố với lượng chính xác lượng cần thiết, sao cho tất cả các nguyên tố phải được tiêu thụ hết tại cuối kì tăng trưởng. Tuy nhiên, rất khó khăn có thể đạt được điều này do tính đa dạng của các nguyên tố và sự phụ thuộc của chúng vào điều kiện nuôi cấy.Tất nhiên, trong công nghệ sinh học, việc tối ưu hóa môi trường là rất quan trọng để tính toán sự tiêu thụ chất dinh dưỡng và để hạn chế tối đa sự hao phí nguyên liệu, hóa chất. Bảng 13.14: Các nhân tố tăng trưởng sản lượng của các chất cho và nhận điện tử
a. Đối với các cơ chất khử là methane hoặc n-alkanes. b. Đối với các chất oxy hóa là glucose. c. Đối với Paracoccus denitrificans với nguồn carbon là glutamate 13.2. CÁC LOẠI HÌNH DINH DƯỠNG CỦA VI SINH VẬTVi sinh vật có tính đa dạng rất cao cho nên các loại hình dinh dưỡng (nutritional types) là khá phức tạp. Căn cứ vào nguồn C, nguồn năng lượng, nguồn điện tử, có thể chia thành các loại sau đây (bảng 13.15) Bảng 13.15:
Các loại hình dinh dưỡng của vi sinh vật (I)
Có thể mô hình hóa chức năng sinh lý của các chất dinh dưỡng đối với sự sinh trưởng của vi sinh vật qua hình 13.3 sau đây:
Hình 13.3: Mô hình sơ lược về chức năng sinh lý của các chất dinh dưỡng đối với sự sinh
trưởng của vi sinh vật. Có thể đem phần lớn vi sinh vật phân thành bốn nhóm chính (bảng 13.16) Bảng 13.16: Các loại hình dinh dưỡng của vi sinh vật (II)
Loại Tự dưỡng quang năng vô cơ còn được gọi là Photolithotrophic autotrophy; loại Dị dưỡng quang năng hữu cơ còn được gọi là Photoorganotrophic heterotrophy; loại Tự dưỡng hóa năng vô cơ còn được gọi là Chemolithotrophic autotrophy; loại Dị dưỡng hóa năng hữu cơ còn được gọi là Chemoorganotrophic heterotrophy. Chúng ta sẽ xem xét kỹ hơn các quá trình trao đổi chất của từng nhóm vi sinh vật này trong chương Trao đổi chất. Các vi sinh vật thuộc loại hình Tự dưỡng quang năng vô cơ và Dị dưỡng quang năng vô cơ có thể lợi dụng ánh sáng để sinh trưởng. Chúng có vai trò quan trọng trong quá trình diễn biến của môi trường sinh thái trong giai đoạn cổ xưa của Trái đất. Vi sinh vật Tự dưỡng hoá năng vô cơ phân bố rộng rãi trong đất và trong nước, chúng tham gia tích cực vào các vòng tuần hoàn vật chất trên Trái đất. Vi sinh vật Dị dưỡng hoá năng hữu cơ dùng chất hữu cơ vừa làm nguồn carbon vừa làm nguồn năng lượng. Hầu hết các loài vi khuẩn, nấm, động vật nguyên sinh đã biết đều thuộc loại hình Dị dưỡng hoá năng hữu cơ. Tất cả các vi sinh vật gây bệnh đã biết đều thuộc loại này. Trong loại hình dị dưỡng hoá năng hữu cơ lại chia thành hai nhóm: Nhóm Hoại sinh (metatrophy) dùng chất hữu cơ chết (xác động thực vật) để làm nguồn carbon. Nhóm Ký sinh (paratrophy) ký sinh trên cơ thể thực vật, người và động vật để hấp thu chất dinh dưỡng. Chúng không thể sống được khi tách rời khỏi vật chủ. Tuy nhiên giữa hai nhóm này còn có những loại hình trung gian là Hoại sinh không bắt buộc (facultive metatrophy) và Ký sinh không bắt buộc (facultive paratrophy). Một số chủng vi sinh vật phát sinh đột biến (đột biến tự nhiên hay đột biến nhân tạo) mất đi năng lực tổng hợp một (hoặc một số) chất cần thiết cho sinh trưởng (thường là nhân tố sinh trưởng như aminoacid, vitamin), chúng chỉ sinh trưởng được khi bổ sung vào môi trường các chất này. Người ta gọi chúng là loại hình Khuyết dưỡng (auxotroph). Các chủng hoang dại tương ứng được gọi là loại hình Nguyên dưỡng (prototroph). Người ta thường sử dụng các chủng vi sinh vật khuyết dưỡng trong nghiên cứu Di truyền học vi sinh vật. Không có ranh giới tuyệt đối giữa các loại hình dinh dưỡng của vi sinh vật. Vi sinh vật dị dưỡng không phải tuyệt đối không sử dụng được CO2 mà chỉ là không thể dùng CO2 làm nguồn carbon duy nhất hay chủ yếu để sinh trưởng. Trong điều kiện tồn tại chất hữu cơ, chúng vẫn có thể đồng hóa CO2 để tạo ra tế bào chất. Tương tự như vậy, vi sinh vật tự dưỡng không phải là không có thể sử dụng chất hữu cơ để sinh trưởng. Ngoài ra, một số vi sinh vật có thể thay đổi loại hình dinh dưỡng khi sinh trưởng trong những điều kiện khác nhau. Ví dụ vi khuẩn phi lưu huỳnh màu tía (purple nonsulfur bacteria) khi không có chất hữu cơ có thể đồng hóa CO2 và thuộc loại vi sinh vật tự dưỡng; nhưng khi có chất hữu cơ tồn tại thì chúng lại có thể sử dụng chất hữu cơ để sinh trưởng và lúc đó chúng là các vi sinh vật dị dưỡng. Hơn nữa, vi khuẩn phi lưu huỳnh màu tía trong điều kiện kỵ khí và có chiếu sáng có thể sinh trưởng nhờ năng lượng của ánh sáng và thuộc loại dinh dưỡng quang năng; nhưng trong điều kiện hiếu khí và không chiếu sáng thì chúng lậi sinh trưởng nhờ năng lượng sinh ra từ quá trình oxy hóa chất hữu cơ và thuộc loại dinh dưỡng hóa năng. Tính biến đổi loại hình dinh dưỡng ở vi sinh vật rõ ràng là có lợi cho việc nâng cao năng lực thích ứng của chúng đối với sự biến đổi của điều kiện môi trường. 13.3. MÔI TRƯỜNG NUÔI CẤY (Culture medium)Môi trường nuôi cấy là các cơ chất dinh dưỡng được pha chế nhân tạo nhằm đáp ứng cho yêu cầu sinh trưởng, phát triển và sản sinh các sản phẩm trao đổi chất của vi sinh vật. Môi trường dinh dưỡng dùng trong nghiên cứu vi sinh vật và trong quá trình sản xuất các sản phẩm của vi sinh vật. Môi trường dinh dưỡng là yếu tố quan trọng trong công nghiệp lên men, công nghiệp sinh tổng hợp nhờ vi sinh vật. 13.3.1. Nguyên tắc pha chế môi trường nuôi cấy1) Chọn các chất dinh dưỡng thích hợp: Nói chung môi trường dinh dưỡng cần đáp ứng các nhu cầu của vi sinh vật về nguồn C, nguồn N, nguồn muối khoáng, nguồn nhân tố sinh trưởng và nước. Vì loại hình dinh dưỡng của vi sinh vật là phức tạp, các vi sinh vật khác nhau có những yêu cầu không giống nhau về các chất dinh dưỡng cho nên có rất nhiều công thức pha chế môi trường nuôi cấy. “Sách Danh lục môi trường nuôi cấy” (A Compilation of Culture Media) xuất bản từ năm 1930 cũng đã ghi tới trên 2500 loại môi trường nuôi cấy khác nhau. Môi trường nuôi cấy vi sinh vật tự dưỡng hoàn toàn pha chế từ các hợp chất vô cơ. Ví dụ để nuôi cấy vi khuẩn Thiobacillus thiooxidans gồm có các thành phần như sau (g/l): (NH4)2SO4 -0.4; MgSO4.7H2O - 0,5; FeSO4 - 0,01; KH2PO4 - 4; CaCl2 - 0,25; S- 10; pH: 7,0, khử trùng ở 121° C trong 20 phút. Các vi khuẩn này sử dụng CO2 trong không khí (hay hòa tan trong nước) để cung cấp nguồn carbon. Với các vi sinh vật tự dưỡng quang năng ngoài việc cung cấp các chất dinh dưỡng cần tiết còn cần chiếu sáng để cung cấp năng lượng cho chúng. Đối với vi sinh vật dị dưỡng cần cung cấp chất hữu cơ và nhu cầu dinh dưỡng của các nhóm khác nhau là rất khác nhau. Để nuôi cấy vi khuẩn Escherichia coli có thể dùng môi trường khá đơn giản sau đây (g/l): Glucose - 5; NH4H2PO4- 1; MgSO4.7H2O - 0,2; K2HPO4 - 1; NaCl - 5; pH: 7,0-7,2, khử trùng ở 112° C trong 30 phút. Nhưng cũngcó những vi khuẩn dị dưỡng yêu cầu những môi trường nuôi cấy rất phức tạp. Ví dụ vi khuẩn Lactobacillus bifidus cần môi trường sau đây (trong 1 lít môi trường đậm đặc gấp đôi) : K2HPO4 - 5g; Na-Acetat - 50g; NZ Case Peptone- 10g; Lactose- 70g; Alanin, Cystin, Tryptophan- mỗi loại 0,4g; Asparagin- 0,2g; Xanthin, Adenin, Guanin, Uracin - mỗi loại 0,02g; Dung dịch Muối B- 10ml; Pyridoxin-HCl - 2,4mg ; Tiamin-HCl - 0,4mg; Riboflavin- 0,4mg; Acid nicotinic- 1,2mg; Ca-Pentotenat - 0,8mg ; Biotin- 8,0 mcg (microgram); Acid folic- 20 mcg; Acid p-aminobenzoic- 20 mcg; Tween 80 - 1g. Điều chỉnh pH đến 6,8. Thêm bằng thao tác vô trùng 100ml dung dịch Acid ascorbic 1% đã lọc qua nến lọc vi khuẩn. Điều chỉnh đến pH 6,5. Lại thêm bằng thao tác vô trùng Sữa người đã loại kem sao cho nồng độ đạt được là 2%. Dung dịch Muối B có thành phần như sau (g/l): MgSO4.7H2O-10; FeSO4.7H2O-0,5; NaCl-0,5; MnSO4.2H2O- 0,337. Thông thường để thay cho các nhân tố sinh trưởng người ta thường dùng Peptone (thay cho từng aminoacid) và cao nấm men (thay cho các nhân tố sinh trưởng). Môi trường thường dùng để nuôi cấy các vi khuẩn dị dưỡng là Môi trường Cao thịt-Pepton với thành phần như sau (g/l): Cao thịt (Beef extract) - 5; Peptone- 10; NaCl- 5; pH: 7,0-7,2; khử trùng ở 121° C trong 20 phút. Môi trường để nuôi cấy vi khuẩn Brevibacterium spp. có thành phần như sau (g/l): Cao nấm men (Yeast extract)-10; Glucose- 20; CaCO3 - 20. Người ta chia môi trường nuôi cấy thành nhiều loại khác nhau.
Môi trường thiên nhiên (complex medium): đây là loại môi trường chứa các chất hữu cơ thiên nhiên không biết rõ thành phần hóa học hoặc thành phần hóa học không ổn định, vì vậy còn được gọi là môi trường không xác định về hóa học (chemically undefined medium). Các môi trường Cao thịt-Pepton, môi trường Mạch nha, môi trường LB (Luria-Bertani) là các ví dụ của loại môi trường này. Thành phần của môi trường LB là như sau (g/l): Peptone - 10; Cao nấm men - 5; NaCl -10; pH: 7,0; khử trùng ở 1210C trong 21 phút. Cao thịt là nước chiết thịt được cô đặc lại. Cao thịt chứa các chất đạm hữu cơ, đường, vitamin, muối khoáng- tất cả đều dễ tan trong nước. Peptone là dạng thủy phân bằng protease hay bằng acid đối với thịt, casein, gelatin sau đó làm khô lại thành dạng bột. Peptone chứa phong phú các chất đạm hữu cơ, cũng có một số vitamin và đường. Cao nấm men là dịch tự phân (autolysate) tế bào nấm men được cô đặc lại. Cao nấm men chứa phong phú vitamin nhóm B, cũng có chứa các chất đạm hữu cơ và đường. Ngoài các loại nói trên môi trường thiên nhiên còn được chế tạo từ các nguyên liệu khác như nước chiết khoai tây, nước chiết giá đậu, nước chiết đất, nước chiết rơm rạ, nước chiết lông vũ bột ngô, cám gạo, sữa, huyết thanh, nước ép cà rốt, nước dừa. Vi sinh vật ưa phân (coprophilous microorganisms) có thể dùng nước phân làm chất dinh dưỡng. Giá thành của môi trường thiên nhiên thường thấp, cho nên không chỉ được sử dụng trong phòng thí nghiệm mà còn có thể được sử dụng trong các xí nghiệp lên men công nghiệp. Bảng 13.17: Thành phần một số loại peptone và dịch thủy phân protein
Chú thích: (1)- Các polypeptid cao phân tử được kết tủa bằng tannin khi có mặt 2% H2SO4. (2)- Các polypeptid được kết tủa bằng tannin khi môi trường có phản ứng trung tính. (3)- Các aminoacid tự do và các peptid không bị ết tủa bởi tannin. Môi trường tổng hợp (synthetic medium): đây là loại môi trường có thành phần hóa học được biết rõ cho nên còn được gọi là môi trường xác định về hóa học (chemically defined medium). Ví dụ môi trường Gause thích hợp cho Xạ khuẩn với thành phần như sau (g/l): Tinh bột tan - 20; KNO3 - 1; NaCl - 0,5; K2HPO4 .3H2O - 0,5; K2HPO4 .3H2O - 0,5; FeSO4 .7H2O- 0,01, pH: 7,2-7,4; khử trùng ở 1210C trong 21 phút. Môi trường tổng hợp có giá thành cao và trên loại môi trường này vi sinh vật phát triển tương đối chậm, nói chung thích hợp sử dụng trong phạm vi phòng thí nghiệm. Có những
vi khuẩn đòi hỏi các môi trường tổng hợp khá đơn giản, chẳng hạn như vi
khuẩn Escherichia coli với môi trường sau đây: K2HPO4-7,0g;
KH2PO4-2,0g; (NH4)2SO4-1,0g;
MgSO4-0,1g; CaCl2-0,02g; Glucose-4-10g; Nguyên tố
vi lượng (Fe,Co,Mn,Zn,Cu,Ni,Mo)-mỗi loại 2-10μg; Nước cất- 1000ml.
Escherichia coli Có những vi sinh vật đòi hỏi các môi trường tổng hợp rất phức tạp (và đắt tiền). Sau đây là ví dụ về môi trường tổng hợp dùng để nuôi cấy vi tảo Euglena: acid glutamic-6g; acid aspartic-4g; Glycine-5g; Sacchaose-30g; Acid malic-1,04g; Acid boric-1,14mg; Thiamine HCl-12mg; KH2PO4- 0,6g; MgSO4-0,8g; CaCO3-0,16g; (NH4)2CO3- 0,72g; FeCl3-60mg; ZnSO4- 40mg; MnSO4-6mg; CuSO4- 0,62mg; CoSO4- 5mg ; (NH4)2MoO4- 1,34mg; Nước 1000ml.
Môi trường đặc (solid medium): đây là loại môi trường được làm đông đặc lại nhờ có bổ sung thêm thạch (agar-agar), gelatin hay silica gel. Môi trường đặc phải đảm bảo được các yêu cầu sau đây: - Không bị vi sinh vật nuôi cấy sử dụng.
Rau câu chỉ vàng -Giữ được trạng thái đặc trong nhiệt độ nuôi cấy vi sinh vật. Dễ hòa tan khi đun nóng (thường được điều chỉnh bằng lượng chứa chất làm đặc trong môi trường) -Nhiệt độ để làm đặc môi trường không quá thấp. -Chất làm đặc môi trường không có hại đôi với vi sinh vật -Chất làm đặc không bị phá hủy khi khử trùng môi trường -Giữ được trạng thái trong suốt của môi trường. -Giá thành không quá cao, pha chế môi trường dễ dàng.
Người đầu tiên nghĩ đến sử dụng môi trường đặc trong nghiên cứu vi sinh vật là Robert Koch khi tình cờ thấy các khuẩn lạc của vi khuẩn trên củ khoai tây và ông đã dùng các lát khoai tây để làm môi trường phân lập vi khuẩn vào năm 1881. Người đầu tiên dùng gelatin để chế tạo môi trường đặc cũng vào năm này là một trợ lý của Koch, ông Frederick Loeffler. Việc dùng thạch để làm chất đông đặc là do cô Minora Tarazaemon phát hiện; khi nấu thức ăn với tảo biển và khi để nguội cô thấy thức ăn đông đặc lại (1882). Người đầu tiên dùng thạch thay thế gelatin trong môi trường nuôi cấy là vợ của Walther Hess (một trợ lý khác của Koch) - bà Fannie Eilshemius Hess. Sau đây là vài đặc điểm chủ yếu của Thạch và Gelatin:
Môi trường bán đặc (semisolid medium): Môi trường bán đặc là môi trường chỉ chứa 0,2-0,7% thạch và thường được sử dụng để quan sát khả năng di động của vi sinh vật, quan sát hiệu giá thực khuẩn thể (phage)... Môi trường dịch thể (liquid medium): Môi trường dịch thể hay môi trường lỏng là các môi trường không bổ sung các chấy làm đông đặc môi trường. Để thông khí phải dùng tới máy lắc hay các nồi lên men có hệ thống thổi khí vô trùng (vô khuẩn) và hệ thống khuấy đảo làm tan đều bọt khí. Môi trường dịch thể ngoài việc sử dụng trong nghiên cứu tại phòng thí nghiệm còn được sử dụng rộng rãi trong sản xuất lớn tại các nhà máy lên men công nghiệp. - Căn cứ vào mục đích sử dụng người ta chia môi trường nuôi cấy thành nhiều loại khác nhau Môi trường cơ sở (minimum medium): Các vi sinh vật tuy có yêu cầu dinh dưỡng không giống nhau nhưng nói chung về cơ bản thì các chất dinh dưỡng là giống nhau. Môi trường cơ sở là môi trường có chứa các chất dinh dưỡng cơ bản cần thiết cho sự sinh trưởng, phát triển của đa số vi sinh vật. Môi trường cơ sở thông dụng là Môi trường cao thịt - peptone. Môi trường cơ sở được dùng làm thành phần cơ bản cho những môi trường đặc biệt, tùy theo yêu cầu của từng nhóm vi sinh vật mà bổ sung thêm các chất dinh dưỡng cần thiết. Môi trường làm giàu hay còn gọi là môi trường gia phú (enrichment medium): Trên môi trường cơ sở cho thêm một số chất dinh dưỡng đặc biệt để thích hợp với việc nuôi cấy một số nhóm vi sinh vật. Các chất bổ sung thêm có thể là máu, huyết thanh, cao nấm men, mô động vật hay thực vật. Ví dụ để nuôi cấy vi khuẩn Bordetella pertussis người ta dùng môi trường cơ sở Difco 0048 nhưng bổ sung bằng thao tác vô trùng máu thỏ (đã lọc qua nến lọc) sau khi đã khử trùng môi trường 15 phút ở 1210C, sao cho nồng độ cuối là 15%.
Bordetella pertussis Môi trường giám biệt (differential medium) Môi trường giám biệt dùng trong việc giám định các loài vi sinh vật khác nhau để xác định vị trí phân loại của chúng. Các môi trường giám biệt và phương pháp sử dụng đã được trình bày trong Tập I (Thế giới vi sinh vật). Chẳng hạn khi xác định khả năng sinh protease thì bổ sung casein hay gelatin, khả năng sinh amylase thì thêm tinh bột tan, khả năng sinh lipase thì thêm dầu ăn và chỉ thị màu, khả năng sinh H2S thì thêm Pb acetat, ..Người ta thường dùng môi trường EMB (Eosin Methylene Blue) để giám biệt vi khuẩn đường ruột. Môi trường này có thành phần như sau: Peptone-10g; Lactose-5g; Saccharose-5g K2HPO4- 2g; EosinY-0,4g; Methylene Blue-0,065g; Nước cất-1000ml; pH=7,2. Môi trường này ức chế vi khuẩn Gram (+) và một số vi khuẩn Gram (-). Từ môi trường này kiểm tra thêm một vài thí nghiệm với các khuẩn lạc xuất hiện có thể phân lập được nhiều loại vi khuẩn đường ruột Gram (-) theo sơ đồ sau đây: a- Lên men lactic, sinh acid. b- Sinh acid mạnh,khuẩn lạc chiếu sáng thấy có màu tía, phản quang có màu lục ánh kim ...Escherichia coli bb-Sinh acid yếu, khuẩn lạc có màu nâu gụ ...Enterobacter,Serratia, Klebsiella, Hafnia aa- Không lên men lactic, không sinh acid, khuẩn lạc trong vô màu... Proteus, Salmonella, Shigella. Môi trường chọn lọc (Selective medium) Dùng môi trường chọn lọc để phân lập từng nhóm vi sinh vật riêng biệt từ một quần thể vi sinh vật trong tự nhiên. Dựa vào yêu cầu dinh dưỡng đặc biệt của từng nhóm vi sinh vật hoặc tính mẫn cảm khác nhau đối với hóa chất, với chất kháng sinh mà đưa thêm vào môi trường những chất tương thích, nhằm ức chế sự sinh trưởng của các nhóm vi sinh vật khác và giúp cho phân lập được nhóm vi sinh vật cần nghiên cứu. Có những môi trường chọn lọc được thiết kế dựa trên nhu cầu dinh đưỡng đặc biệt của từng nhóm vi sinh vật nhất định. Ví dụ dùng cellulose hay dầu parafin làm nguồn carbon duy nhất khi phân lập nhóm vi sinh vật phân hủy celluose hay phân hủy parafin, dùng protein làm nguồn nitrogen duy nhất để phân lập vi sinh vật sản sinh proteinase, dùng môi trường không chứa nitrogen để phân lập vi sinh vật cố định nitrogen. Ví dụ môi trường vô đạm Ashby dùng để phân lập vi khuẩn Azotobacter có thành phần như sau: Mannit-1%; KH2PO4-0,025%, MgSO4.7H2O-0,02%; NaCl-0,02%; CaSO4.2H2O-0,01%; CaCO3-0,5%. Cũng có loại môi trường chọn lọc thêm 10% phenol sẽ làm ức chế sự sinh trưởng của vi khuẩn và vi nấm nhưng lại có thể phân lập được xạ khuẩn. Nếu thêm vào môi trường Bi sulphat thì có thể ức chế được các vi khuẩn Gram (+)và phần lớn các vi khuẩn Gram (-), nhưng lại phân lập được vi khuần thương hàn (Salmonella typhi). Thêm vào môi trường Brilliant green hay Crystal violet thì ức chế được vi khuẩn Gram (+) nhưng lại phân lập được vi khuẩn Gram (-). Trêm vào môi trường Streptomycin thì có thể ức chế được nhiều loại vi khuẩn nhưng lại phân lập được vi nấm. Thêm vào môi trường Na propionat có thể ức chế được nấm sợi nhưng lại phân lập được nấm men. Trong Kỹ thuật di truyền (Genetic engineering) người ta thường xuyên sử dụng các môi trường chọn lọc chứa các kháng sinh xác định để tách ra các chủng mang gen tái tổ hợp. Trong thực tế có những môi trường vừa là môi trường chọn lọc, vừa là môi trường giám biệt. Ví dụ để phân lập tụ cầu khuẩn vàng (Staphylococcus aureus) người ta thêm vào môi trường 7,5% NaCl, Mannit và chỉ thị màu acid-kiềm. Vi khuẩn này vừa chịu được nồng độ NaCl cao , vừa chuyển hóa mannit thành acid.
Staphylococcus aureus Sau đây là một số chất được bổ sung vào môi trường (MT) chọn lọc khi cần thiết để phân lập một số nhóm vi sinh vật nhất định: Potassium tellurite (MT Mueller tellurite) để phân lập Corynebacterium diphtheriae; Tellurite và Crystal violet (MT Mitis-salivarius) để phân lập Streptococcus; Na azide (MTAzide glucose) để phân lập Streptococcus; Phenylethanol (MT Phenylethanol) để phân lập Staphylococcus và Streptococcus; Nước ép cà chua (MT nước ép cà chua) để phân lập vi khuẩn lactic từ nước bọt; Desoxycholate, citrate (MT Desoxycholate citrate) để phân lập vi khuẩn đường ruột Gram(-); Mật(bile),citrate, brilliant green (MT SS) để phân lập Salmonella và Shigella; Malachite green dye (MT Lowenstein-Jensen) để phân lập Mycobacterium; Chloramphenicol (MT Emmon) để phân lập nấm; Rose Bengal và Streptomycin (MT Martin) để phân lập nấm...
Corynebacterium diphtheriae Ngoài các loại môi trường kể trên còn có các loại môi trường đặc biệt khác. Đó là Môi trường phân tích (assay medium) dùng để định lượng vitamin, chất kháng sinh... Đó là Môi trường khử (reduced medium) dùng để nuôi cấy các vi sinh vật kỵ khí. Đó là Môi trường nuôi cấy mô (Tissue-culture medium) chuyên phục vụ cho việc nuôi cấy tế bào và mô động, thực vật, hoặc dùng để nuôi cấy trên tế bào các nhóm vi sinh vật chuyên ký sinh như virút, Chlamydia, Rickettsia, Spirochete. Một số virút và Rickettsia không phát triển được trên các môi trường nhân tạo mà phải nuôi cấy trên phôi gà, trên tế bào thận khỉ, trên cơ thể động vật thực nghiệm. Dưới đây là một vài gợi ý quan trọng khi chuẩn bị môi trường nuôi cấy. Rất nhiều đường dễ bị phân giải trong quá trình khử trùng ở pH kiềm (đặc biệt với sự có mặt của photsphate và peptone), làm cho màu môi trường chuyển thành màu nâu và các sản phẩm tạo thành có thể ức chế sự sinh trưởng của vi sinh vật. Để tránh tình trạng đó, người ta khử trùng ở môi trường pH acid nhẹ hoặc khử trùng riêng biệt đối với đường. Tất cả các kim loại vi lượng dễ dàng tạo nên muối photphat không tan và kết tủa trong môi trường nuôi cấy. Điều này có thể được tránh bằng cách bổ sung thêm các nhân tố có ái lực với kim loại (metal-chelating agents) như là EDTA (Ethylene Diamine Tetraacetic Acid) hay NTA (Nitrilotriacetic acid) hay đôi khi là các axit cacboxylic như citrate hay tartrate. Việc thêm các nhân tố này có hiệu quả hai mặt. Một mặt, nó ngăn chặn sự kết tủa của các kim loại vi lượng, mặt khác nó hoạt động giống như một bể chứa các kim loại đó, bằng cách này có thể làm giảm tính độc nhờ giảm nồng độ tự do của chúng (tới mức mà các vi sinh vật có thể sử dụng được). Ở môi trường pH >7, các kim loại kiềm thổ Ca và Mg (dưới dạng vi lượng) dễ dàng kết tủa với sự hiện diện của photphate (hay sự có mặt của ion carbonate khi sử dụng môi trường đệm là bicarbonat, hay có sẵn trong nước cứng) tạo nên hàm lượng muối không tan cao. Những kết tủa này đôi khi khó thấy bằng mắt thường, đặc biệt trong các bình nuôi cấy lắc do thể tích nhỏ của môi trường. Để tránh điều này, môi trường có thế được khử trùng ở pH hơi axit (pH được điều chỉnh sau), hay muối photphat được khử trùng riêng rẽ với môi trường và kết hợp sau khi đã làm nguội. Cần chú ý rằng đa số các môi trường cổ điển sử dụng trước những năm 60 của thế kỷ trước thường không bao gồm các nguyên tố vi lượng. Sự thêm vào thường là không cần thiết bởi vì các nguyên tố vi lượng đã có chứa sẵn trong các muối không tinh sạch được sử dụng để chuẩn bị cho môi trường. Môi trường hiện nay được chuẩn bị với các muối tinh sạch cao nên không đáng ngạc nhiên là sẽ thất bại trong việc tạo ra nhiều sinh khối sản phẩm nếu không được bổ sung các nguyên tố vi lượng vào trong môi trường. Một ví dụ điển hình là môi trường cổ điển M9 được sử dụng rất rộng rãi cho sự sinh trưởng của E.coli trong các nghiên cứu di truyền. Môi trường này không cung cấp thuận lợi các nguyên tố vi lượng cho sự phát triển của E.coli trong một vài thế hệ, sau đó chúng sinh truởng chậm lại và cuối cùng là ngừng lại.
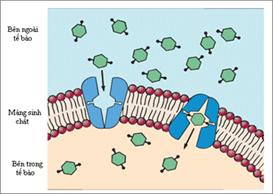
Để tồn tại, sinh trưởng và phát triển, tế bào vi sinh vật phải thường xuyên trao đổi vật chất và năng lượng với môi trường bên ngoài. Một mặt chúng tiếp nhận các chất dinh dưỡng từ môi trường, mặt khác chúng thải ra môi trường một số sản phẩm trao đổi chất. Tế bào vi sinh vật sử dụng các chất dinh dưỡng bắt đầu từ việc hấp thu chúng. Cơ chế của sự hấp thu này có tính chuyên hóa, nói cách khác chúng chỉ hấp thu các chất cần thiết, việc hấp thu các chất không sử dụng được là bất lợi đối với tế bào. Vi sinh vật thường sống trong các môi trường nghèo chất dinh dưỡng, do đó chúng phải có năng lực vận chuyển chất dinh dưỡng từ môi trường có nồng độ thấp vào môi trường có nồng độ cao bên trong tế bào, tức là ngược lại với gradient nồng độ. Như thế là giữa trong và ngoài tế bào có một hàng rào thẩm thấu, đó là màng sinh chất có tính thẩm thấu chọn lọc. Chúng cho phép các chất dinh dưỡng xâm nhập vào tế bào và cản trở các chất khác. Do tính đa dạng và phức tạp của các chất dinh dưỡng nên vi sinh vật có nhiều phương thức khác nhau để vận chuyển các chất dinh dưỡng. Quan trọng nhất là cách Khuếch tán xúc tiến (Facilitated diffusion), cách Vận chuyển chủ động (Active transport) và cách Chuyển vị nhóm (Group translocation). Ở các vi sinh vật có nhân thật không thấy có cách Chuyển vị nhóm nhưng có cách sử dụng quá trình Nhập bào (Endocytosis).Cấu tạo của màng sinh chất được biểu thị qua hình 13.6 sau đây:
Hình 13.6: Cấu trúc của màng sinh chất (Theo sách của Prescott, Harley và Klein).
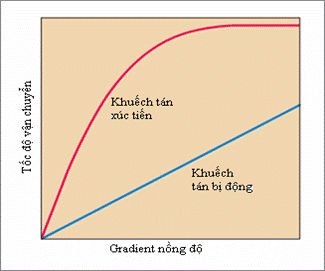
13.4.1. Sự khuếch tán xúc tiến (Facilitated Diffusion)Một số ít các chất, như glycerol, có thể đi qua màng tế bào chất theo phương thức Khuyếch tán bị động (Passive diffusion). Khuyếch tán bị động còn được gọi tắt là Khuyếch tán, đó là việc các chất dinh đưỡng chuyển từ chỗ có nồng độ cao đến chỗ có nồng độ thấp. Khuyếch tán bị động muốn làm cho tế bào hấp thụ có hiệu quả một số chất dinh dưỡng cần có nồng độ chất này bên ngoài tế bào cao hơn bên trong. Tốc độ hấp thu tùy theo lúc tế bào tăng lượng hấp thu chất này mà giảm xuống. Trừ phi loại chất dinh dưỡng này sau khi xâm nhập tế bào lập tức được sử dụng và không làm nâng cao nồng độ chất đó trong tế bào. Chỉ có nước (H2O), O2 và CO2, là những phân tử rất nhỏ mới thường được vận chuyển qua màng bằng phương thức khuếch tấn bị động. Các phân tử tương đối lớn hơn, các ion và các chất có tính cực (polar substances) khó có thể đi qua màng sinh chất băng phương thức khuếch tán bị động.
Hình 13.7: Khuếch tán bị động (đường thẳng) và khuếch tán xúc tiến (đường cong) (Theo sách của Prescott, Harley và Klein). Protein mang (carrier protein) còn gọi là enzim permease là một loại protein gắn trên màng. Với sự hỗ trợ của permease có thể nâng cao rất nhiều tốc độ khuếch tán qua màng có tính thẩm thấu chọn lọc. Phương thức vận chuyển qua màng với sự hỗ trợ của permease được gọi là sự khuếch tán xúc tiến (facilitated diffusion). Tốc độ của quá trình khuếch tán xúc tiến tăng lên khi sự chênh lệch nồng độ chất dinh dưỡng giữa trong và ngoài tế bào tăng lên. Khi nồng độ các chất dinh dưỡng tương đối thấp thì khuôn khổ tăng lên cao hơn so với phương thức khuếch tán bị động. Lúc gradient nồng độ đạt tới một trị số nhất định thì dẫn đến hiệu ứng bão hòa. Sự tham gia của Permease đã làm dẫn đến hiệu ứng bão hòa (hình 13.7) Đáng chú ý là, lúc permease bị bão hòa, sự khuếch tán xúc tiến không tăng lên do sự tăng mức chênh lệch chất dinh dưỡng trong và ngoài tế bào. Quan hệ giữa tốc độ khuếch tán xúc tiến và gradient nồng độ chất dinh dưỡng tưong tự như mối quan hệ giữa enzyme và cơ chất, và khác hẳn với đường biểu diễn thẳng phản ánh sự khuếch tán bị động. Ngoài ra sự giống nhau giữa permease và enzyme còn ở chỗ có tính chuyên nhất đối với chất vận chuyển, mỗi loại permease chỉ có thể vận chuyển một cách chọn lọc đối với một số chất tương thích. Dù có sự tham gia của permease nhưng khuếch tán xúc tiến vẫn đúng là phương thức vận chuyển khuếch tán. Việc vận chuyển vẫn phải dựa vào sự chênh lệch nồng độ chất dinh dưỡng giữa trong và ngoài màng. Khi mất đi sự chênh lệch nồng độ sự vận chuyển sẽ dừng lại. Quá trình này không cần tới năng lượng trao đổi chất (metabolic energy) của tế bào. Gradient nồng độ có thể duy trì khi tế bào chuyển biến chất dinh dưỡng được vận chuyển thành một hợp chất khác hoặc chuyển chất dinh dưỡng đó tới một vị trí khác của màng (ở sinh vật có nhân thật). Thật thú vị khi thấy một số permease này liên quan đến protein chủ chốt của thấu kính mắt ở động vật có vú, đó là các protein thuộc họ MIP. Trong vi khuẩn 2 loại kênh MIP phân bố rộng rãi nhất là aquaporins vận chuyển nước và glycerol facilitators (các nhân tố xúc tiến glycerol) vận chuyển glycerol. Mặc dầu đã có rất nhiều nghiên cứu đối với cơ chế khuếch tán xúc tiến nhưng quá trình này vẫn chưa được hiểu biết một cách đầy đủ. Hình như phức hợp permease xuyên ngang qua màng tế bào. Sau khi chất dinh dưỡng được kết gắn bên ngoài màng, cấu hình của permease phát sinh biến hóa để phóng thích được chất dinh dưỡng vào bên trong màng. Permease sau đó lại hồi phục lại cấu hình ban đầu và sẵn sàng để đón nhận phân tử dinh dưỡng khác bên ngoài màng. Kết quả của quá trình này là một phân tử không tan trong lipid có thể đi vào tế bào đáp lại gradient nồng độ của nó. Nên nhớ rằng, cơ chế này có thể đảo ngược bởi gradient nồng độ, nếu nồng độ một số vật chất trong tế bào cao hơn bên ngoài thì cũng có thể thông qua phương thức này mà chuyển vận ra ngoài tế bào. Vì thông qua hoạt động trao đổi chất mà tế bào tiêu hao rất nhanh các chất dinh dưỡng đưa vào tế bào nên không có chuyện chất dinh dưỡng bị đưa ngược ra ngoài (hình 13.8). Ở các sinh vật nhân nguyên thủy quá trình khuếch tán xúc tiến không phải là phương thức vận chuyển chủ yếu vì nồng độ chất dinh dưỡng bên ngoài tế bào thường rất thấp cho nên không thể thực hiện được quá trình khuếch tán xúc tiến để hấp thụ chất dinh dưỡng. Glycerol được vận chuyển bởi quá trình khuếch tán xúc tiến ở E.coli, Salmonella typhimurum, Pseudomonas, Bacillus và nhiều vi khuẩn khác. Sự khuếch tán xúc tiến thường gặp ở tế bào sinh vật nhân thực, chúng dùng phương thức vận chuyển này để chuyển vận các loại đường và amino acid vào tế bào.
Hình 13.8. Một kiểu Khuếch tán xúc tiến (Theo sách của Prescott, Harley và Klein) 13.4.2. Sự vận chuyển chủ động (Active Transport) Mặc dầu sự khuếch tán xúc tiến giúp chuyển vận có hiệu quả chất dinh dưỡng vào bên trong tế bào khi nồng độ chất hòa tan bên ngoài cao hơn bên trong tế bào, nhưng không thể vận chuyển được chất dinh dưỡng khi nồng độ chất hòa tan trong tế bào cao hơn bên ngoài. Vi sinh vật thường sống trong các môi trường có nồng độ chất dinh dưỡng rất thấp, để có thể sinh trưởng và phát triển chúng phải có thể vận chuyển và hấp thu được từ môi trường các chất dinh dưỡng có nồng độ thấp. Khi đó khuếch tán xúc tiến không còn là phương thức vận chuyển hữu hiệu nữa mà phải có những phương thức vận chuyển khác, trong đó quan trọng nhất là phương thức vận chuyển chủ động (active transpore) và phương thức chuyển vị nhóm (group translocation); cả hai phương thức này đều cần tới năng lượng. Sự vận chuyển chủ động là loại phương thức vận chuyển các phân tử chất hòa tan tới nơi có nồng độ cao hơn, tức là ngược lại với gradient nồng độ và cần phải tiêu hao năng lượng. Vì sự vận chuyển chủ động cần tới các protein mang (permease) nên tương tự với sự khuếch tán xúc tiến trong một số phương diện. Permease có tính chuyên nhất cao đối với các phân tử được vận chuyển. Các phân tử chất hòa tan có tính chất tương tự có thể lên kết với permease trong cả hai trường hợp - khuếch tán xúc tiến và vận chuyển chủ động. Trong trường hợp nồng độ các chất dinh dưỡng khá cao sự vận chuyển chủ động cũng có hiệu ứng bão hòa (hình 13.9). Tuy nhiên, sự khác nhau lớn nhất giữa hai loại này là vận chuyển chủ động có thể vận chuyển ngược nồng độ nhưng cần tiêu hao năng lượng trao đổi chất. Các chất ức chế trao đổi chất có thể làm trở ngại việc sản sinh năng lượng do đó làm ức chế sự vận chuyển chủ động, nhưng không làm ảnh hưởng đến quá trình khuếch tán xúc tiến (ngay cả trong thời gian ngắn). Vi khuẩn, cổ khuẩn và các vi sinh vật nhân thật có các hệ thống vận chuyển protein kết hợp (Binding protein transport systems) hoặc protein vận chuyển hình hộp kết hợp với ATP (ATP-binding cassette transporters) hay còn gọi là protein vận chuyển ABC (ABC transporter). Loại protein vận chuyển này thường được tạo thành một phức thể nhờ sự kết hợp giữa hai vùng xuyên màng ưa nước (hydrophobic membrane - spanning domain) trên bề mặt tế bào chất và hai vùng gắn với nucleotide (hình 13.9).
Hình 13.9: Công năng của protein vận chuyển hình hộp có khả năng kết hợp với ATP (Theo sách của Prescott, Harley và Klein) (1)=Protein mang chất hòa tan được gắn với cơ chất vận chuyển và hướng đến phức chất protein vận chuyển ABC (2)=Protein mang chất hòa tan gắn vào protein vận chuyển và phóng thích cơ chất, chuyển qua màng nhờ năng lượng của sự thủy phân ATP Vùng xuyên màng hình thành một lỗ nhỏ trong màng và vùng kết hợp nucleotide sẽ gắn với ATP rồi thủy phân ATP để hấp thụ chất hòa tan. Protein vận chuyển ABC tận dụng protein liên kết cơ chất chuyên biệt nằm trên khe chu chất của vi khuẩn Gram âm hoặc bám trên màng lipid tại mặt ngoài của màng sinh chất ở vi khuẩn Gram dương. Các protein liên kết này (cũng tham gia vào quá trình hóa hướng động-chemotaxis) sẽ gắn với phân tử được vận chuyển, rồi tương tác với protein vận chuyển màng để chuyển phân tử hòa tan vào trong tế bào. Vi khuẩn E.coli đã dùng cơ chế này để vận chuyển nhiều loại đường (arabinose, maltose, galactose, ribose) và aminoacid (glutamate, histidine, leucine). Các chất đưa vào vi khuẩn Gram (+) phải đi qua màng ngoài trước khi phát huy tác dụng của protein vận chuyển ABC và các hệ thống vận chuyển chủ động khác. Các phân tử ngỏ có thể sử dụng một protein lỗ phổ biến như OmpF. Các phân tử lớn hơn phải dùng tới các protein lỗ màng chuyên biệt. Trong một số trường hợp, ví dụ việc hấp thu sắt và vitamin B12 phải dùng tới các protein vận chuyển và protein tiếp nhận màng ngoài có ái lực cao chuyên biệt. Đáng chú ý là protein vận chuyển ABC ở sinh vật nhân thật nhiều khi có tầm quan trọng lớn trong y học. Một số tế bào ung thư sử dụng các protein vận chuyển này để bơm thuốc ra. Việc xơ hóa nang là kết quả của một đột biến làm bất hoạt một protein vận chuyển ABC đối với chuỗi chuyển ion chloride trong phổi. Vi khuẩn cũng dùng gradient proton phát sinh ra khi chuyển vận điện tử để thúc đẩy sự vận chuyển chủ động. Các protein vận chuyển màng chịu trách nhiệmđối với quá trình này thiếu hụt các protein liên kết chu chất chuyên biệt để kết hợp với các chất dinh dưỡng. Lactose permease ở vi khuẩn E.coli là một ví dụ điển hình. Permease này là một protein đơn có phân tử lượng khoảng 30 000. Nó vận chuyển phân tử lactose khi có một proton xâm nhập tế bào (nồng độ proton cao bên ngoài tế bào là do hoạt động của chuỗi chuyển vận điện tử). Sự vận chuyển liên kết của hai cơ chất theo cùng một hướng được gọi là vận chuyển đồng hướng (symport). Trong quá trình này năng lượng tích tụ trong gradient proton được huy động để vận chuyển vật chất. Mặc dầu cơ chế của phương thức vận chuyển này còn chưa được hiểu biết đầy đủ nhưng nói chung được cho rằng proton và permease sau khi kết hợp sẽ cải biến hình dạng và ái lực hấp thụ chất dinh dưỡng. Vi khuẩn E.coli cũng dùng sự vận chuyển đồng hướng với proton để vận chuyển aminoacid và các acid hữu cơ như succinate và malate. Một gradient proton cũng có thể thông qua việc hình thành một gradient ion natri để gián tiếp tác động lên sự vận chuyển chủ động (hình 13.10). Các chất
vận chuyển được chuyển xuyên màng theo phương hướng tương phản như vậy
được gọi là vận chuyển ngược hướng (antiport). Gradient natri sinh ra
trong ngoài tế bào do hệ thống vận chuyển proton ngược hướng này sẽ có
thể dẫn đến việc hấp thu đường và acid amin vào tế bào. Một ion natri có
thể liên kết với một protein mang và gây ra sự biến đổi hình dạng.
Protein mang sẽ kết hợp mật thiết với đường hay acid amin và định hướng
chúng chuyển vào bên trong tế bào. Do nồng độ natri trong tế bào thấp,
ion natri có thể tách rời ra khỏi protein mang và chất dinh dưỡng được
vận chuyển cũng được tách ra theo. Cùng với việc ion natri di động vào
tế bào vi khuẩn E.coli thì protein mang cũng sẽ chuyển đường melibiose
và acid amin glutamate vào tế bào
Hình 13.10: Tác dụng của gradient proton và natri trong vận chuyển chủ động (Theo sách của Prescott, Harley và Klein). 1- Proton bơm ra ngoài màng sinh chất khi vận chuyển điện tử 2-Gradient proton thông qua cơ chế vận chuyển ngược hướng (antiport mechanism) đẻ đẩy ion natri ra ngoài 3- Ion natri liên kết với phức hợp protein mang (carrier protein complex) 4-Điểm kết hợp với chất hòa tan (dung chất) biến đổi hình dạng và gắn với dung chất (đường hoặc aminoacid) 5-Cấu hình của protein mang (carrier) thay đổi, ion natri được chuyển vào trong tế bào và sau đó dung chất cũng rời khỏi protein mang Sự vận chuyển đồng hướng (symport) hay vận chuyển hiệp đồng (cotransport) natri cũng là một quá trình quan trọng ở các tế bào nhân thật (eucaryotic) khi hấp thu đường và acid amin. Nhưng gradient ion natri thường sinh ra do việc thủy phân ATP chứ không phải do lực chuyển động của proton. Vi sinh vật thường thông qua nhiều hệ thống vận chuyển để hấp thu một chất dinh dưỡng. Ví dụ như ở vi khuẩn E.coli, ít nhất cũng có tới 5 hệ thống vận chuyển để hấp thu đường galactose, 3 hệ thống vận chuyển để hấp thu glutamate và leucin, 2 hệ thống vận chuyển để hấp thu ion kali. Khi có nhiều hệ thống vận chuyển như vậy đối với cùng một cơ chất, các hệ thống có sự khác nhau về nguồn năng lượng tiêu hao, về ái lực đối với chất dinh dưỡng và về phương thức điều tiết hệ thống vận chuyển. Tính đa dạng về các phương thức vận chuyển như vậy đã giúp cho vi sinh vật càng có ưu thế cạnh tranh mạnh mẽ trong điều kiện môi trường dễ biến đổi. 13.4.3. Sự chuyển vị nhóm (Group Translocation)Trong việc vận chuyển chủ động, các phân tử hòa tan vận chuyển qua màng mà không cần cải biến. Nhiều vi sinh vật nhân sơ còn có thê thông qua việc chuyển vị nhóm để hấp thu chất dinh dưỡng. Trong quá trình này vật chất được vận chuyển sẽ có phát sinh biến hóa hóa học. Nhóm này có thể xếp vào loại vận chuyển phụ thuộc năng lượng vì cần sử dụng năng lượng trao đổi chất. Hệ thống chuyển vị nhóm quen biết nhất là Phosphoenolpyruvate: hệ thống phosphotransferase đường (PTS). Nhiều loại đường thông qua phương thức vận chuyển này để chuyển vào tế bào vi sinh vật nhân sơ khi bị phosphoryl hóa và sử dụng phosphoenolpyruvate (PEP) làm thể cho phosphate: PEP + Đường (ngoại bào) → Pyruvate + Đường + P (nội bào) PET rất phức tạp, ở vi khuẩn E.coli và Salmonella typhimurium PTS tạo thành bởi 2 enzym (EI và EII) và 1 protein ổn định nhiệt có phân tử lượng thấp (HPr). HPr và Enzym EI là tồn tại trong tế bào chất. Enzym EII có nhiều biến hóa trong cấu trúc, thường do hợp thành bởi 3 tiểu đơn vị (subunits) hay vùng kết cấu (domains), trong đó EIIA (trước đây gọi là EIII) là protein tế bào chất có thể hòa tan, EIIB cũng là một protein ưa nước (hydrophilic), EIIC là protein kỵ nước nằm trên màng tế bào, hai loại sau thường kết hợp lại với nhau. Trong quá trình vận chuyển, dưới tác dụng của EI và HPr một phosphate cao năng từ PEP chuyển đến enzym EII với sự giúp đỡ của Enzym I và HPr. Sau đó EII đưa 1 phân tử đường qua màng vào tế bào và được phosphoryl hóa. EII chỉ vận chuyển chuyên hóa từng loại đường và trong các hệ thống PTS khác nhau có các EII khác nhau, còn EI và HPr là giống nhau trong mọi hệ thống PTS.
Hình 13.11: Chuyển vị nhóm (Theo sách Microbiology của Prescott, Harley và Klein) Hệ thống PTS phân bố rộng rãi ở các vi sinh vật nhân sơ. Các chi vi khuẩn Escherichia, Salmonella, Staphylococcus và các vi khuẩn kỵ khí không bắt buộc (facultatively anaerobic) khác đều có hệ thống PTS. Một số vi khuẩn kỵ khí bắt buộc, như thuộc chi Clostridium, cũng có hệ thống PTS. Một số vi khuẩn thuộc chi Bacillus có cả hai hệ thống Đường phân (Glycolyse) và PTS. Nhưng các vi khuẩn hiếu khí hầu như không có hệ thống PTS. Nhiều carbohydrate được vận chuyển bởi hệ thống này. Vi khuẩn E.coli hấp thu glucose, fructose, mannitol, saccharose, N-acetylglucosamine, cellobiose và nhiều carbohydrate nằng phương thức chuyển vị nhóm. Ngoài vai trò dùng để vận chuyển, protein PTS còn là cơ quan cảm thụ hóa học - cảm thụ khí trong quá trình hóa hướng động. 13.4.4. Sự
hấp thụ Sắt (Iron Uptake)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||