ThS.BÙI TẤN ANH, ThS. VÕ VĂN BÉ,
ThS. PHẠM THỊ NGA Giảng viên
Gs. Bùi Tấn Anh - Võ Văn Bé - Phạm Thị
Nga
Structure des virus
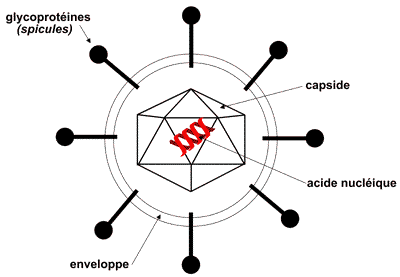
| Enveloppe : propre à certains virus (virus enveloppé).
Son origine est cellulaire. Elle présente une fragilité aux désinfectants.
Capside : représente une protection de l'acide
nucléique. Elle est constituée de protéines assemblées de façon géométrique
dont certaines ont des propriétés antigéniques.
Glycoprotéines : protéines transmembranaires
qui servent de ligand ( clef) pour les récepteurs
( clef) pour les récepteurs cellulaires (serrure), et de système de reconnaissance pour les
anticorps.
cellulaires (serrure), et de système de reconnaissance pour les
anticorps.
Acide nucléique (génome) : A.R.N.
ou A.D.N.
|
 |
Taille des virus
Structures
Par définition toute particule virale est composée
de 2 éléments obligatoires: le génome composé d'acide nucléique et la
capside, coque de nature protéique entourant le génome, l'ensemble constitue
une unité fonctionnelle, la nucléocapside. Pour certains virus seulement,
cette nucléocapside est elle-même entourée d'une structure appelée enveloppe
ou peplos.
Nulle part ailleurs la corrélation entre la structure et la fonction - entre
la composition et l'arrangement du matériel génétique et les mécanismes
d'expression génique - n'est aussi apparente que chez le virus. La diversité
des mécanismes utilisés par le virus pour exprimer ses protéines est reflété
par sa structure génomique (mais, malheureusement, ne pas toujours en être déduite).
3.1 Le génome viral
[top]
Le génome viral contient l'intégralité de l'information génétique de
la particule. Comparé au génome de procaryotes ou cellules eucaryotes, la
quantité de gènes codés par l'acide nucléique est faible: de 3 à 200 gènes.
Il est constitué soit d'ADN soit d'ARN lesquels peuvent être sous formes linéaire
ou circulaire, simple brin (monocaténaire) ou double brins (bicaténaire).
Cette diversité de formes implique que les virus ont développés de multiples
stratégies pour répliquer leur génome. Malgré cette diversité, le génome
de tous les virus encode trois types de protéines, celles qui:
- assurent la réplication du génome
- encapside le génome en particules virales (virion)
- altèrent la structure et/ou fonction de la cellule infectée.
3.1.1 Le génome à ADN
[top]
La taille du génome varie entre 3.2 kilo bases (kb) et 200 kb. Le génome
à ADN est toujours en une seule molécule. Il est en général sous forme d'un
double brin mais certains ADN viraux peuvent être simple brin. L'ADN viral est
en général linéaire mais certains sont sous forme circulaire.
| Virus |
Symétrie |
Lin./Circ. |
Taille en kb |
Maladie |
| Hepadna |
I |
lin./circ. |
3.2 |
Hépatite |
| Parvo |
I |
lin. |
5 |
Erythème |
| Papova |
I |
circ. |
5 |
Dégénérescence du CNS |
| Papilloma |
I |
circ. |
7 |
Carcinomes |
| Adeno |
I |
lin. |
35 |
Maladies respiratoires |
| Herpes |
I |
lin. |
200 |
Herpès, varicelle |
| Variola |
? |
lin. |
200 |
Variole |
3.1.2 Le génome à ARN
[top]
La taille du génome varie entre 1.6 kb à 30 kb. Ces ARNs sont en général
monocaténaires sauf celui de la famille des réovirus qui est bicaténaire. Ils
peuvent être en un seul ou en plusieurs segments, mais en général linéaires.
La disposition en plusieurs segments favorise les recombinaisons génétiques
entre différents virus de la même famille et augmente ainsi la variabilité génétique
et donc antigénique (cf. virus de la grippe)
| Virus |
Symétrie |
Nb. segments |
Sens ARN |
Taille en kb |
Maladie |
| Hépatide D |
|
1 |
- |
1.6 |
Hépatite |
| Parymyxo |
H |
|
- |
15 |
Rougeole,
oreillons |
| Rhabdo |
H |
|
- |
11 |
Rage |
| Picorna |
I |
|
+ |
7 |
Polio, hépatite,
rhume |
| Alpha |
I |
|
+ |
9 |
Rubéole |
| Retro |
I |
|
+ |
10 |
SIDA, lymphomes |
| Corona |
H |
|
+ |
30 |
Rhumes |
| Arena |
H |
2 |
- |
11 |
Fièvre hémorragique |
| Bunya |
H |
3 |
- |
12 |
Encéphalites |
| Orthomyxo |
H |
8 |
- |
12 |
Grippe |
| Rota |
I |
11 |
+/- |
15 |
Diarrhées |
3.2 La capside
[top]
Elle a essentiellement un rôle de protection du génome viral. C'est une
structure polymérisée à base de sous-unités protéiques appelées capsomères.
Le génome des virus étant petit, il ne peut coder que pour un petit nombre de
polypeptides différents. Ainsi les capsides sont constituées par la répétition
d'un seule capsomère, lui-même constitué d'une ou de quelques protéines.
Selon les rapports que les capsomères contractent entre eux et avec le génome,
on définit deux types de nucléocapsides:
3.2.1 les nucléocapsides à symétrie hélicoïdale
[top]
D'aspect tubulaire, les sous-unités s'assemblent en un ruban autour de
l'acide nucléique, et le ruban enroulé autour d'un axe central constitue un
tube plus ou moins rigide. L'exemple le mieux connu est celui du virus de la
mosaïque du tabac.

©Linda Stannard
De nombreux virus animaux et en particulier les Orthomyxoviridae et la
Paramyxoviridae ont une nucléocapsides à symétrie hélicoïdale de même
type. Cependant, à la différence de celle, rigide, des virus des plantes,
elle est plus ou moins flexible, enroulée sur elle-même et toujours incluse
dans un enveloppe. Ceci est illustré par une vue au microscope électronique
(EM) du virus de la grippe. Dans la partie A, la nucléocapside est encore
enfermée dans son enveloppe alors que dans la partie B, la nucléocapside est
partiellement déroulée.

tiré du Fields, Vol1, p 1401 (© G. Murti, St. Jude Childrens Research
Hospital, Memphis)
La vue EM ci-dessous met en contraste la structure rigide du virus de la mosaïque
du tabac (TMV), les bâtonnets, et la structure plus lâche de la nucléocapside
de Sendaï.
 (Kolakofsky
et al., CMU, Geneva University)
(Kolakofsky
et al., CMU, Geneva University)
3.2.2 les nucléocapsides icosaédriques
[top]
Il s'agit d'un polyèdre comprenant 12 sommets et 20 faces égales qui sont
des triangles équilatéraux entourant une sphère. Un icosaèdre possède 3
axes de symétrie: 15 doubles passant par les angles, 10 triples passant par
chaque faces et 6 quintuples passant par chaque pentamère. On parle de symétrie
5:3:2.
Suivant le nombre de protéines formant la capsomère, celles-ci peuvent
s'organiser de plusieurs façons pour former une face de l'icosaèdre. Il y a
plusieurs raisons à ce que les virus ont utilisé une symétrie icosaédrique.
L'une est que la triangulation d'une sphère en 20 est la meilleure façon
d'obtenir une coque faite de structures identiques liées entre-elles. C'est la
structure ayant une énergie libre minimale.
Les deux images ci-dessus proviennent du
laboratoire de Robert
M Bock de UW-Madison.
 |
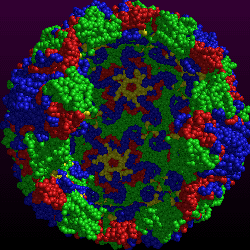 |
| L'illustration de gauche vous montre la
structure icosaédrique de la capside du rhinovirus 14 telle qu'elle a
été déterminée par critallographie aux rayons X. Chaque acide aminé
est représenté par une sphère de 4 Angström de diamètre. La capside
est constituée de 4 protéines VP1 (bleu),
VP2 (vert), VP3
(rouge) et VP4 (pas visible). Sur cette image on aperçoit bien l'axe de
symétrie 5-fois avec VP1 au sommet d'un pentamère. |
L'image de droite nous montre la capside de
rhino 14 où deux pentamères ont été enlevés afin de voir l'intérieur
de la capside où VP4 est maintenant visible en jaune. |
Les nucléocapsides icosaédriques peuvent constituer la particule virale
(virus nu) ou, dans certaines familles de virus ne représenter que la partie
interne du virus, celui-ce étant entouré d'une enveloppe.
Une autre façon de percevoir les protéines virales est de les distinguer en
protéines internes ou protéines externes. Les protéines
externes sont celles qui sont en contact avec l'extérieur alors que les protéines
internes ne le sont pas. Ainsi, dans le cas d'un virus sans enveloppe, les
proteines de la capsides sont des protéines externes alors que dans les virus
à enveloppe les capsomères sont considérées comme des protéines internes.
Cette notion externe/interne est importante car les protéines externes sont
celles qui sont "vues" par l'organisme hôte: spécificité
d'interaction, réaction immunitaires, activité enzymatique (voir ci-dessous).
Les protéines internes peuvent être:
- des protéines de la capside qui sont en contact étroit avec l'acide nucléique,
neutralisant sa charge et facilitant son compactage,
- des enzymes essentielles telles que les transcriptase des virus à ARN négatif
(voir la multiplication).
Structurellement on dit que l'ensemble génome-protéines internes forme le
core.
| Pour en savoir plus |
| Intéressé par la structure fine des virus ? Linda
Stannard, Cape Town University, vous offre de superbes vues au
microscope électronique et vous explique comment elles ont été
faites. (ayez un peu de patience, le site est lent). |
3.3 L'enveloppe virale
[top]
L'enveloppe virale provient des systèmes membranaires de la cellule hôte
par bourgeonnement. Trois origines sont possibles:
- la membrane nucléaire
- la membrane d'une organelle comme le réticulum endoplasmique (RE) ou
l'appareil de Golgi
- la membrane cytoplasmique.
L'enveloppe est composée de la double couche lipidique de la membrane de l'hôte
ainsi que de protéines d'origine virales. Les protéines située du côté
externe de la membrane sont toujours des protéines glycosylées et forment des
spicules appelés aussi des peplomères. Ces dernières sont responsables
d'activités biologiques comme l'hémagglutinine, la neuraminidase, protéines
de fusion des enveloppes lipidiques.
Il faut noter que le caractère lipidique de l'enveloppe la rend très
sensible aux solvants tels que détergents, éther ou sels biliaires. Donc,
l'enveloppe ne constitue pas un élément de protection supplémentaire de la
particule. Cette fragilité a des conséquences en épidémiologie (faible résistance
dans le milieu extérieur et dans les selles, transmission par contact immédiat
et rapproché) et pour le diagnostic (faible probabilité de retrouver le virus
à certains niveaux défavorables comme les matières fécales et nécessité
d'un transport rapide du produit pathologique au laboratoire).
Multiplication
Nous avons vu que le thème récurant chez les
virus était "diversité". Nous allons voir que leur mode de
multiplication n'échappe pas à ce thème. Néanmoins tous les virus obéissent
à une stratégie de multiplication fondamentale que l'on peut découper
en cinq étapes:
- l'adsorption
- la pénétration
- la décapsidation
- la réplication (duplication du génome, transcription, traduction)
- l'assemblage et la libération
Ces étapes sont illustrées par le cycle du virus de la grippe,
Influenza
|
|
 |
|
4.1 L'adsorption
[top]
L'adsorption du virus consiste en la liaison d'une protéine virale à
un récepteur de la surface cellulaire. Les deux exemples les plus étudiés
d'interaction virus-récepteur sont:
| Virus |
Protéine virale |
Récepteur |
| Influenza |
haemaglutinine |
acide N-acetyl neuraminique
(acide sialique) |
| HIV |
glycoprotéine de
l'enveloppe (gp120) |
CD4 des lymphocytes T4 ainsi
que les co-récepteurs aux chemokines
CXCR4 ou CCR5 ou CCR3 |
Certains virus (vaccinia, herpès simplex) peuvent avoir plusieurs molécules
différentes pour s'attacher aux récepteur, ou une même molécule
d'attachement peut avoir plusieurs domaines pouvant chacun s'attacher à
des récepteurs différents.
Les récepteurs peuvent être des protéines ou le sucre attaché à une
glycoprotéine ou glycolipide. Le nombre de récepteurs par cellule peut
varier énormément selon le récepteur. L'expression (ou l'absence) de récepteurs
à la surface des cellules détermine en grande partie le tropisme de la
plupart des virus, c'est-à-dire le type de cellule dans laquelle ils sont
capables de se répliquer.
L'attachement est un processus souvent réversible. Certains virus (ortho-
et paramyxovirus) portent à leur surface une neuraminidase qui leur
permet de se détacher de leur récepteur en clivant l'acide neuraminique
terminal porté par la chaîne polysaccaridique du récepteur.
4.2 La pénétration
[top]
A la différence de l'adsorption, la pénétration est un processus
qui requiert de l'énergie. Elle peut se faire par trois mécanismes ou
une combinaison de ceux-ci (influenza, voir ci-dessous):
- translocation de virus entier au travers de la membrane plasmique
- endocytose du virus et accumulation des particules virales dans les
vésicules cytoplasmiques
- fusion de l'enveloppe virale avec la membrane cellulaire
Les virus non-enveloppés utilisent les deux premiers mécanismes pour
pénétrer dans la cellule.
Les virus à enveloppe utilisent leur protéines de fusion, qui
interagissent avec des protéines de la membranes cellulaire, pour réaliser
cette étape. Si l'activité de cette protéine de fusion se fait à pH
neutre, comme chez HIV et les paramyxovirus, il a y fusion avec la
membrane cytoplasmique et la nucléocapside entre directement dans le
cytoplasme.
D'autres virus, comme le virus de la grippe, ont une protéine de
fusion active seulement à un pH acide. Une fois attaché au récepteur,
le complexe virus-récepteur est internalisé par endocytose dans des vésicules
recouvertes de clathrine. En migrant vers l'intérieur de la cellule, ces
vésicules perdent la clathrine et enclenchent une pompe à protons qui
baisse le pH interne. A pH acide, la protéine de fusion (agglutinine)
change de conformation, devient active et fusionne l'enveloppe virale à
la membrane de l'endosome.
Dans les deux cas, l'enveloppe virale reste dans les membranes et la
nucléocapside est de ce fait libérée dans le cytoplasme.
4.3 La décapsidation
[top]
La décapsidation est un terme général qui s'applique aux événements
qui se passent immédiatement après la pénétration et conduisent à la
mise à nu du génome viral, en général sous la forme d'un complexe nucléoprotéique
(core).
Pour les virus qui se répliquent dans le cytoplasme (p. ex.
Picornavirus), le génome est directement accessible une fois la décapsidation
accomplie. Pour les virus qui se répliquent dans le noyau (p. ex.
Herpesvirus), la capside est transportée du site d'entrée vers les pores
nucléaires par des protéines du cytosquelette. Une fois le pore nucléaire
atteint, l'ADN viral (nu ou complexé avec des protéines) est relâché
dans le noyau et la capside se désintègre.
Dans certains cas, par exemple chez les Réovirus, le génome viral
exprime toutes ses fonctions à l'intérieur d'une capside rendue perméable.
4.4 La réplication du génome viral
[top]
L'élément clé dans la réplication virale est la synthèse des protéines
virales par la machinerie cellulaire. Pour ce faire, le virus doit présenter
aux ribosomes cellulaires un ARN messager (mRNA). De ce point de vue la
cellule impose trois contraintes aux virus.
Premièrement la cellule synthétise ses propres mRNAs dans le noyau par
la transcription de ses gènes par des ARN polymérases en des pre-mRNAs
qui sont ensuite processés en mRNAs matures. Dès lors la cellule ne possède
pas a) les enzymes nécessaire pour synthétiser un mRNA à partir d'un génome
viral à ARN et b) les enzymes capables de transcrire l'ADN viral dans le
cytoplasme. En conséquence seuls les virus à ADN qui vont dans le noyau
peuvent tirer parti des ARN polymérases de l'hôte pour faire synthétiser
leur propre mRNAs.
Deuxièmement la machinerie de synthèse protéique de l'hôte est
seulement capable de traduire des mRNAs monocistroniques, autrement dit
elle est incapable de reconnaître des signaux internes d'initiation et
doit commencer la traduction depuis l'extrémité 5' du mRNA. En conséquence,
le virus doit soit synthétiser des mRNAs séparés pour chaque gènes,
soit un grand mRNA codant pour un polyprotéine qui doit être ensuite
clivée en protéines individuelles.
Troisièmement, dans la cellule, l'expression du génome viral entre en
compétition avec une myriade de gènes cellulaires. C'est pourquoi les
virus ont dû développer des stratégies qui soit confèrent à leur
mRNAs un avantage compétitif soit abolissent la synthèse ou traduction
des mRNAs cellulaires.
En fonction de la nature de leur génome, les virus peuvent être classés
en 7 groupes:
- virus à ADN double brins: adénovirus, herpesvirus, poxvirus
- virus à ADN simple brin de sens +: parvovirus
- virus à ARN double brin: reovirus, birnavirus, orbivirus
- virus à ARN simple brin de sens +: picornavirus, togavirus
- virus à ARN simple brin de sens -: orthomyxovirus, rhabdovirus,
paramyxovirus
- virus à ARN simple brin de sens + avec ADN intermédiaire: rétrovirus
- virus à ADN double brin avec ARN intermédiaire: hepadnavirus
|
|
4.4.1 Virus à ADN double brin
[top]
Cette classe peut-être divisée en deux groupes:
- a) virus dont la réplication est exclusivement nucléaire
(p. ex. Adenovirus, Papovavirus, herpesvirus).
- La transcription du génome viral se fait par cycles de
transcriptions successifs. Le premier cycle est appelé
"transcription précoce" et les produits de la traduction de
ces mRNAs sont des protéine nécessaires à la réplication du génome
viral (p. ex réplicases) ou les protéines de contrôle qui bloquent
la synthèse de l'acide nucléique de la cellule. Le niveau de cette
transcription et de la traduction qui en découle est très bas par
rapport à celui de la "transcription tardive" où les protéines
structurales du virus sont produites.
- b) virus dont la réplication est cytoplasmique
(p. ex. Poxvirus)
- Comme on peut le déduire de par leur localisation, ces virus
apportent avec eux toute la panoplie d'enzyme nécessaires pour la
transcription/réplication et sont donc largement indépendant de la
machinerie enzymatique de l'hôte
|
|
|
 |
| Pour en savoir plus |
| DNA transforming virus, notes du cours
BS335 donné par le Dr. Shaun Heaphy.
Plus spécifiquement sur les familles:
|
|
|
4.4.2 Virus à ADN simple brin de sens (+)
[top]
(p. ex. Parvovirus)
-
- La réplication a lieu dans le noyau. Elle implique la synthèse
d'un brin complémentaire de sens (-) qui sert de matrice pour la
synthèse du génome.
|
|
 |
|
|
|
|
|
4.4.3 Virus à ARN double brins
[top]
(p. ex. Réovirus)
-
- Ces virus ont un génome segmenté qui est transcrit à l'intérieur
de la capside par une RNA polymérase empaquetée dans le virion. Les
mRNA produits sont sécrétés dans le cytoplasme et servent deux
fonctions: 1) de mRNA monocistronique pour la production de protéines
virales et 2) de matrice pour la synthèse du brin complémentaire
afin de reformer le génome viral double brin.
|
|
 |
|
|
| Pour en savoir plus |
| La famille des Réovirus |
|
|
4.4.4 Virus à ARN simple brin de sens (+)
Par convention, les virus dont le génome sert de mRNA sont appelés
virus à brins positif (+). Cette famille peut être divisée en deux
groupes:
[top]
a) virus codant pour un seul mRNA de la taille du génome entier
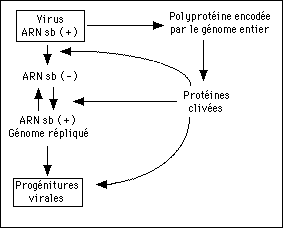
(p. ex. Picornavirus, Hépatite A, Polio virus)
- Après avoir pénétré dans la cellule le génome de ces virus se
lie aux ribosomes pour produire une polyprotéine. Cette protéine géante
est ensuite clivée en protéines individuelles. Le RNA génomique (+)
sert de matrice à la synthèse d'un brin complémentaire (-) par une
polymérase virale (elle-même produit du clivage de la polyprotéine
précurseur).
Ce brin (-) servira à produire d'autres brins (+) qui eux-mêmes
servent à produire plus de polyprotéines, plus de brins (-) et
finalement les constituants de la progéniture.
|
|
 |
|
|
|
|
|
- b) virus codant un ou plusieurs mRNAs de taille inférieure au génome
(p. ex. Togavirus)
- Deux ou plusieurs cycles de traduction sont nécessaires pour
produire le RNA génomique
|
|
 |
|
|
| Le
point central dans la réplication des virus à brin (+) est le fait que
le génome sert de mRNA directement après l'infection. Ceci a deux conséquences.
La première est que les enzymes nécessaires à la réplication du génome
sont produits à partir du génome et donc le virus ne doit pas les
emporter dans sa capside. C'est pour cela que le RNA génomique est
infectieux. Deuxièmement, parce que tous les génomes des virus à ARN
simple brin (+) sont monopartites, le produit initial du mRNA génomique
est nécessairement une protéine unique géante. Cette protéine doit être
coupée en protéines individuelles trouvées dans le virion ou la cellule
infectée. Ce clivage est en partie auto-catalytique et en partie réalisé
par des protéases cellulaires. |
|
4.4.5 Virus à ARN simple brin de sens (-)
[top]
On peut distinguer deux groupes:
- a) les virus à génome non segmenté
(p. ex. Paramyxovirus, Rhabdovirus, Filovirus)
- Du fait de sa polarité, l'ARN génomique de ces virus ne peut pas
être directement traduit et n'est donc pas infectieux. Parce que la
cellule ne possède pas l'enzyme qui permet de synthétiser le brin
(+) complémentaire à l'ARN génomique, le virus doit l'apporter avec
lui lors de l'infection. La première étape d'une telle infection est
la transcription du virus en une série de mRNAs monocistroniques de
longueur inférieure à celle de l'ARN génomique (= transcription
primaire). La traduction de ces mRNAs produit les protéines nécessaires
à la réplication du génome. Celle-ci se fait par la synthèse d'un
ARN de brin (+) qui est le complément exact du génome viral. Par
l'intermédiaire de cet antigénome, la réplication du génome peut
avoir lieu. Ces génomes amplifiés servent à leur tour de matrice
pour de nouveaux mRNAs, de matrice pour de nouveaux intermédiaires de
réplication (brin (+)), ou de génomes constituant la progéniture.
Les génomes et antigénomes fonctionnels sont toujours constitués
d'un complexe ARN/protéine (nucléocapside).
|
|
 |
|
|
| Pour en savoir plus |
| La famille des:
|
|
|
Chez les Paramyxovirus on observe parfois que les mRNA produits
contiennent des nucléotides non encodés par le génome. Ceux-ci sont
insérés dans les mRNAs par un mécanisme de "glissage" (le même
nucléotide de la matrice est lu plusieurs fois) de la RNA polymérase
virale. Ceci conduit à la production de protéines ayant la même extrémité
amino-terminale mais qui diffèrent par leur extrémité
carboxy-terminale. C'est un mécanisme permettant de produire deux protéines
différentes à partir d'un même gène.
-
- b) les virus à génome segmenté
(p. ex. Orthomyxovirus, Bunyavirus).
- La réplication se fait comme chez les virus à génome non segmenté
sauf que les mRNAs sont produits à partir de chaque segment de RNA génomique.
Cette disposition en plusieurs segments favorise les recombinaisons génétiques
entre les virus de cette famille augmentant ainsi la variabilité génétique
de ces virus.
|
|
4.4.6 Virus à ARN simple brin de sens (+) avec
production d'un ADN intermédiaire
[top]
(p. ex. Rétrovirus)
-
- La caractéristique des rétrovirus est le fait que la particule
virale contient deux copies identiques du RNA génomique, lui-même
non segmenté. Bien que de sens positif, l'ARN génomique sert
uniquement de matrice à la formation du DNA double brin intermédiaire.
La cellule ne possède pas d'enzyme capable de faire du DNA à partir
de RNA. C'est pourquoi, le rétrovirus doit apporter cet enzyme avec
lui. On l'appelle la transcriptase reverse. Une fois synthétisé dans
le cytoplasme, le DNA double-brin est transporté dans le noyau et
s'intègre dans le génome de la cellule. Le génome intégré est
ensuite transcrit par l'ARN polymérase cellulaire en mRNAs et en ARN
génomique complet introduit dans la progéniture.
|
|
 |
|
|
|
|
|
|
4.4.7 Virus à ADN double brin avec production
d'un ARN intermédiaire.
[top]
(p. ex. Hepadnavirus)
-
- Le génome du virus de l'hépatite B se réplique dans le noyau.
L'ADN linéaire est converti en ADN circulaire par une ADN polymérase
apportée par le virus. Ce génome est ensuite transcrit en deux
classes d'ARN: les mRNAs servant à la production de protéines
virales et un mRNA de la longueur du génome entier qui sert de
matrice pour la synthèse de l'ADN génomique par l'ADN polymérase
virale qui sert ici de transcriptase réverse
|
|
 |
|
|
|
|
|
4.5 L'assemblage et la libération
[top]
Les virus ont développé trois types de stratégies pour leur
encapsidation et libération de la cellule.
1. D'une manière générale, les virus qui n'ont pas d'enveloppe ont un
assemblage indépendant de la libération. Cette dernière se passe
normalement quand la cellule est détruite par l'effet de l'infection.
On parle alors de virus lytique.
2. La seconde stratégie est celle développée par les virus à
enveloppe. Pour ces virus, l'assemblage et la libération sont liés
dans le processus de bourgeonnement. Il faut noter que le processus de
bourgeonnement ne se fait pas forcément au détriment de la cellule-hôte.
Dans ce cas, les cellules peuvent être infectées d'une façon
persistante, c'est-à-dire quelles peuvent continuer à se multiplier
tout en libérant des virus.
|
|
|
 |
|
|
3. La troisième stratégie est celle développée par les virus comme
celui de l'herpès. L'assemblage de ce dernier se fait dans le noyau où
il acquiert une membrane dérivée de la lamelle interne du noyau. De là,
le virus passe dans le réticulum endoplasmique d'où une vésicule
contenant le virus se forme pour le transporter à la surface de la
cellule. Le virus est libéré par la lyse de la cellule.
Conclusion.
Une connaissance de la biologie des virus et plus spécifiquement de l'éventail
des hôtes, des cellules cibles, ainsi que des stratégies de
multiplication sont les clés du développement de méthodes effectives
dans la prévention et le traitement des maladies virales.
|
|
| 19
novembre 2003, ds |
|
|
|
|
|
|
|
|
|
|