|
Những bài cùng tác giả
Lịch sử, tiến trình sinh sản, và phận sự cua miRNA trong sinh hoc:
miRNA là những đoạn RNA ngắn khoảng từ 19 - 22 nucleotide đã được phát
hiện từ lâu trong di truyền vi sinh vật, động vật, thực vật và người.
Nhưng mãi đến năm 1993, lần đầu tiên, việc tách ly và phân tích định
tính miRNA lin-4 và let-7 của sâu Caenorhabditis elegans, một loại sâu
sinh sống ở trong đất, rau đậu bị hư thối… mới được hoàn tất.
Hai miRNA này giữ vai trò quan trọng trong việc điều tiết ở thời kỳ phát
triển nhộng (larval development) của loại sâu đất này. Mặc dầu công
trình nghiên cứu về vai trò (phận sự) của miRNA trong tế bào chưa được
hoàn toàn thành công, nhưng các chuyên gia đã có bằng chứng cho thấy sự
hiện diện của miRNA có liên quan đến sự tăng trưởng của mô và tế bào.
Khác với RNA thônng tin (mRNA – messenger RNA), miRNA không tham gia vào
quá trình sinh tổng hợp protein, nên đã được đặt tên là non-protein
coding RNA (RNA không mã hoá protein). Trong các chương trình nghiên cứu
y dược, các chuyên gia trong ngành thường chỉ chú trọng đến cách tổng
hợp các hóa chất, peptide nhân tạo có khả năng hạn chế, gây trở ngại,
tàn phá hoặc làm triệt tiêu cơ chế phát sinh protein, hay tác động đến
chính protein có hại cho nông nghiệp và nhân loại. Cũng vì không giữ vai
trò trong sinh tổng hợp protein cho nên miRNA đã bị lãng quên trong quá
trình nghiên cứu y dược. Trong quá trình sinh học, miRNA Gene đã được
tác đông bởi enzyme RNA Polymerase II, chuyển hoán và tạo ra microRNA
nguyên thủy, được gọi là pri-miRNẠ. Đây là chuỗi RNA dài hàng nghìn
base, và mang đầu 5'-CAP, và đầu 3' là gốc đa A (Poly-A, AAAA...).
Pri-miRNAs chứa đựng ít nhất một hay nhiều vòng kẹp tóc (Hairpin), mỗi
vòng dài khoảng ~70 nucleotides. Cũng như tất cả các RNA khác (kể cả
mRNA), pri-miRNA bị tác động cắt đoạn bởi hai enzymes là DROSHA ở trong
nhân và DICER ở trong tế bào chất (Cytoplasm). Sự cắt đoạn này tạo ra
các đoạn miRNA có hoạt tính tương tự như siRNA (small interfering RNA).
MiRNA kết hợp với RNA Interference (RNAi) dưới sự hiện diện của phức
hợp RISC (RNA-induced Silencing Complex) sẽ tác động lên một phần của mRNA
dưới dạng kết hợp cặp base (Base-pairing) để tiết chế việc tiếp tục sinh
sản hay phân giải mRNA đã phát sinh trong tế bào. Sự chuyển hoán trong
quá trình sinh học tạo ra miRNA và quá trình tác động của miRNA lên mRNA
được mô tả trong Hình 1.
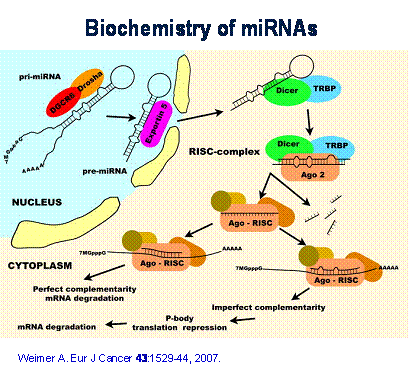
Hình 1: Tiến trình phát sinh và cơ chế phản ứng của microRNA trong sinh
thể, nội dung của tiến trình được tóm tắt như sau:
1. miRNA có chiều dài khoảng 19-24 nucleotides, được tạo ra (sinh sản) từ
tác động cắt đoạn các Hairpin trong pre-miRNA, dài khoảng 60 - 110
nucleotides, bởi hai enzymes DROSHA, và DICER.
2. Gần 70% các miRNA được phát sinh liên quan đến sự điều tiết trong quá
trình tạo (sinh sản) mRNAs và các RNAs không sinh tổng hợp proteịn. Tuy
nhiên, số còn lại được phát sinh độc lập, không phụ thuộc vào quá trình
trên. Cho đến nay, các chuyên gia chưa xác định được chức năng của các RNA
này
3. miRNA có thể điều tiết sự phân giải mRNA với sự hiện diện của phức hợp
RISC (RISC complex), trong trường hợp bổ sung hoàn toàn (Perfect
Complementary), quá trình này được gọi là RNAi.
4. Trong trường hợp bổ sung không hoàn toàn (imperfect complementary) với
3'UTR của mRNA, sự chuyển hoán sẽ bị tiết giảm và bị chậm bớt.
5. miRNA có thể tác động lên gần 200 phiên bản RNA (RNA transcripts) và
nhiều miRNA có thể tác động ảnh hưởng điều tiết lên một Gene mã hoá protein
(protein-coding Gene).
6. Các chuyên gia ước lượng rằng hơn 50% gene mã hóa protein của người
đang bị kiểm soát bởi miRNA
Cơ chế của RNA-Antisense để làm trở ngại tiến trình miRNA:
Vì miRNAs đã không giữ vai trò trực tiếp trong quá trình tổng hợp
protein, cho nên các công trình nghiên cứu về miRNA đã không được quan
tâm. Khoảng 15 năm gần đây, các chuyên gia đã đề ra công trình nghiên
cứu mới, nhắm đến các giai đoạn trước khi sinh sản ra mRNA, ứng dụng
song song với việc triển khai của ngành DNA/RNA Antisense. Kết quả là họ
đã tim thấy được hoạt tính kháng ung thư trong các phòng thí nghiệm cấy
mô, các hoạt tính này cho thấy rõ được ứng dụng hữu hiệu của ngành
Antisense trong các phòng thí nghiệm.

Hammond S. M., TRENDS in Molecular Medicine, 12, 3, 99-101, 2006
Hinh 2:
Tiến trình phát sinh miRNA và thời điểm có sự tác động của miRNA
Antisense Inhibitors:
miRNA được sinh sản bởi RNA Polymerase II, sau khi đươc tác động
bởi DROSHA trong nhân, vòng RNA (có cấu tạo Stem-Loop), là tiền micro RNA,
được gọi la pre-miRNA, được thẩm thấu sang tế bào chất, và ở đó sẽ bị cắt
bởi DICER thành miRNA 22 nucleotides. Trong hình này, nếu miRNA kết hợp với
RNA Antisense nhân tạo Antagomir, có khả năng kết hợp mạnh hơn mRNA theo
chiều mũi tên đỏ) thì sẽ sinh ra chuỗi RNA nguyên thủy, và quá trình trở lại
từ đầu.
Mục đích của việc khảo cứu Antisense RNA trong những năm gần đây:
Hiện nay có khoảng 4167 miRNA đã được đăng ký, lấy
từ sinh vật như thảo mộc, vi sinh vật, động vật chân khớp (arthropods) và
đông vật có xương sống (vertebrates) như chim, cá, người. Cho đến nay các
chuyên gia đã tách ly và định cấu trúc của hơn một nghìn miRNAs cho người,
và trong số đó có đến 474 miRNA (theo Hammond) đã được định tính và tất cả
các chi tiết được ghi nhận trong mạng http://microrna.sanger.ac.uk . Như vậy
chúng ta có thể suy luận rằng miRNA chính là nguồn tiết chế quá trình sinh
hoc của mRNA dựa trên sự kết hợp cặp đôi base (Base-paring) giữa nó, miRNA
và mRNA. Vấn đề các chuyên gia đang quan tâm là làm sao có thể ức chế quá
trình kết hợp này. Các chuyên gia đã thành công trong việc dùng các RNA
Antisense nhân tạo chứa những gốc có vai trò làm tăng hoạt tính kết hợp bổ
sung cặp base (base-paring complementary) của RNA. Các RNA Antisense này sẽ
phải có cấu trúc giống như mRNA về cặp base (base-pairing) và phải có hoạt
tính kết hợp cao hơn mRNA để có thể tác động lên miRNA trước khi để miRNA
tác động lên mRNA. Các RNA Antisense nhân tạo đối với miRNA này sẽ có thể
làm cản trở (trở ngại) sự tiến triển của quá trình này dựa trên cơ chế tác
động của RNA Antisense.
Nhằm gia tăng thời gian sống (time-life), gia tăng tính bền nhiệt
(thermal stability), gia tăng dung điểm (melting temperature) và họat tinh
của các RNA nhân tạo, các chuyên gia Antisense đã dùng các phương pháp sau
đây:
1. Biến đổi đầu 3' và 5' (3'- and 5'-ends modification) làm tăng thời
gian sống (tính sinh tồn) của RNA nhân tạo: Thông thường các enzyme cắt
DNA/RNA từ đầu 3' dến đầu 5', nhưng cũng có enzyme cắt từ đầu 5' đến đầu 3'.
Để bảo vệ hai đầu của RNA nhân tạo tránh khỏi phản ứng của Enzyme, người ta
thường thay thế hai gốc nối phos-phát P=O ở hai đầu thành phosphorothioate
(P=S) hoặc phosphoramidate (P-N) hay bằng các liên kết amine (amine-linker)
ngắn hay các hóa chất thông thường như Cholesterol, Cyclodextrin. Các hóa
chất này có thể làm giảm hiệu năng phân giải của Enzyme và làm tăng thời
gian sống của RNA nhân tạo trong quá trình sinh học.
2. Dùng các hóa chất có tính kị nước (hydrophobic), ưa nước (hydrophilic)
hay polyamine ở đầu 3' hay đầu 5' để làm gia tăng tính thẩm thấu qua màng tế
bào và màng nhân tế bào: nhiều thi nghiệm cho thấy rằng các hóa chất có tính
kị nước cao như cholesterol, pyrene hay ưa nước cao như cyclodextrin và các
đa amine (polyamine)....đã giúp việc chuyển DNA/RNA qua màng của tế bào hữu
hiệu hơn.
3. Dùng các RNA nhân tạo với sự biến đổi các gốc 2'-Oxy để làm gia tăng
tính bền nhiệt (Thermal Stability, melting temperature) của RNA nhân tạo:
2'-Omethyl, 2'-amino, 2'-O-Alkyl, 2'-Fluoro, LNA (Lock Nucleic Acid).
Các nỗ lực nghiên cứu hóa học tổng hợp nhằm sản xuất các nhóm
oligonucleotides (DNA/RNA) nhân tạo có hoạt tính có thể dùng trong y dược
đang là một đề tài sốt dẻo tại các nước phát triển. Trong 25 năm qua, các
chuyên gia trong ngành Antisense Oligonucleotides DNA/RNA đã đạt được một số
thành quả ứng dụng đáng kể. Đây chính là nhân tố kích thích việc nghiên cứu
trong ngành này trong những năm gần đây. Để tìm ra loại oligonucleotides
DNA/RNA nhân tạo nào đó có nhiều gốc biến đổi hóa học mà vẫn có thể hòa tan
dễ dàng trong dung dich nước, có thể bền vững trong những phản ứng phân giải
của Enzymes, có thể có tính kết hợp base-pairing rất chặt chẽ với các
Oligonucleotides DNA/RNA thiên nhiên và nhất là với các gốc hóa học mới này,
oligonucleotides vẫn sẽ cho thấy được đặc tính sinh học của nó ứng dụng được
trong y dược. Mới đây, LNA (Lock Nucleic Acid, Hình 3), với cấu trúc
hóa học được biến đổi nhưng vẫn mang đủ điều kiện như một RNA nucleoside.
LNA Oligonucleotides sẽ có đặc điểm là xương sống phos-phat LNA sẽ không bị
dễ dàng phân giải hoàn toàn, hay biến đổi từ 3'-Oxy, sang 2'-Oxy ở trong các
môi trường dung dịch với pH>7.0 và pH<7.0, các oligonucleotides thuộc loại
này sẽ rất vững bền trước phản ứng của Enzymes, và có tính bền nhiệt
(Thermal Stability, Tm) khi có kết hợp base-pairing với các RNA thiên nhiên.

Hình 3: LNA với A, G, C, U là các base.
Cấu trúc của LNA ở trên cho thấy LNA mang một cầu nối methylene từ
2'-Oxy đến 4'-Carbon, đã biến nucleoside RNA này thành cấu tạo vòng kép.
Và cũng vì cầu nối methylene này mà LNA oligonucleotide sẽ không ở vị
trí tự do như RNA thường. Kết quả nghiên cứu của việc áp dụng biến đổi
oligonucleotides thường thành oligonucleotides mang 2 vòng (vòng kép như
trường hợp LNA) hay 3 vòng (ở gốc vòng Pentafuranose (Carbohydrate), đều
gia tăng tính bền nhiệt hay nhiệt dung (Thermal Stability or melting
temperature, Tm, increased). LNA oligonucleotide kết hợp với DNA, hay
với RNA sẽ có dung điểm tăng lên từ +3˚C tới +4˚C so với RNA thường kết
hợp với DNA hay RNA. Cũng vì đặc tính của cầu nối này mà các chuyên gia
đã quan sát được sự gia tăng hoạt tính kháng sinh của các nucleoside có
chứa vòng kép, thí dụ như Locked AZT-triphosphate, có hoạt tính mạnh hơn
AZT triphosphate thuờng (Jesper Wengel et al. J. Chem. Soc., Perkin
Trans.1, 1407-1414, 1999).

Hình 4: Pentafuranose của LNA (b) bị khóa không còn có dạng C2'-endo
(S-type), hay C3'-endo (N-type) như trong cấu trúc của nucleotide thường
(a).
Wengel et al quan sát thấy LNA không còn có dạng C2'-endo (S-type), hay
C3'-endo (N-type) như trong cấu trúc của nucleotide thường (a). Mà LNA
còn có cấu tạo lập thể quang hóa học vì mang vòng kép ở Pentafuranose,
chỉ tồn tại dưới một dạng (b). như được mô tả trong
Hình 4 trên. Cấu
trúc lập thể của hai LNA oligonucleotides được diễn tả dưới đây (Wengel
et al. TRENDS in Biotechnology 21, 2, 74-81, 2003).

Hình 5: LNA Với cấu trúc β-D, LNA với cấu trúc α-L
Các chuyên gia đã triển khai LNA rộng rãi hơn, bằng cách biến đổi cấu
trúc sẵn có của LNA nguyên thủy để tìm cách gia tăng hoạt tính y dược
của oligonucleotides, bằng cách thêm các gốc mới như methyl, amino,
linkers..., hay các nguyên tố khác như Sulphur, Nitrogen, Fluorine…, hay
thay đổi cấu trúc từ β-D- (Hình 5) sang β-L-cấu trúc, hai cấu trúc này
có sự đối xứng qua gương phẳng (Stereoisomer), hay từ α-LNA sang
α-L-LNA, hay sang xylo-LNA . Các chuyên gia vẫn quan sát thấy sự gia
tăng hoạt tính sinh tồn va` ổn định nhiêt, cho cả các trường hợp LNA,
α-L-LNA (Hình 5), và các LNA có cấu trúc liên quan khác, được mô tả
trong Hình 6 dưới đây.

Hình 6: Các cấu trúc của các LNA, với các gốc biến đổi đã được tổng hợp,
và thử nghiệm.
Tổng hợp và tinh chế RNA Antisense:
Các chuyên gia cũng đang cố gắng trong quá trình sản suất dùng máy tổng
hợp DNA/RNA để sản xuất 400 umole Antisense RNA cho miRNA, là những đoạn
RNA ngắn khoảng từ 19 - 22 nucleotides để làm thuốc, cho ra tương đương
với 10 gram sản phẩm thô. Tổng hợp RNA khó hơn việc tổng hợp DNA vì RNA
mang gốc OH ở vị trí carbon 2', tương đối gần với trung tâm phản ứng
phosphat ở vị trí carbon 3' ngay bên cạnh, trên cấu trúc vòng
Pentofuranose của nucleotide. Hơn thế nữa gốc OH này lại phải đươc bảo
vệ bởi nhóm hóa chất Alkylsilyl (thường là t-butyl-dimethyl silyl). Gốc
bảo vệ này sẽ che chở cho RNA được toàn vẹn trong các quá trình hậu tổng
hơp.
Vì RNA nguyên thủy sẽ bị dễ dàng cắt ra thành nucleoside trong dung dịch
có điều kiện pH cao (pH > 7) và xương sống oligonucleotides dễ bị chuyển
hoán từ 3'-Oxy sang 2'-Oxy trong dung dịch có điều kiện pH thấp (pH <
7), khi đó các gốc bảo vệ sylyl không còn tồn tại trên RNA
oligonucleotides.
Các chuyên gia dùng sắc ký lỏng cao áp (HPLC) cho thấy sản phẩm từ máy
tổng hợp (synthesizer) chứa nhiều đoạn N-minus. Chất N-minus này sinh ra
sau mỗi vòng phản ứng của máy vì hiệu ứng của mỗi vòng phản ứng (~98%)
thấp hơn so với hiệu ứng nhận được trong việc tổng hợp DNA (99.5%). Họ
đã dùng HPLC để tinh chế, tuy nhiên các chuyên gia chỉ lấy được sản phẩm
với độ tinh chế là 88% cho lần tinh chế bằng HPLC. Để đạt được tiêu
chuẩn do Bộ Y Tế Hoa Kỳ, US-FDA đề ra là 98+% cho Antisense, các chuyên
gia phải dùng phương pháp tinh chế kép bằng HPLC (Double Purification
Process), hoặc phải chấp nhận hiệu suất tinh chế thấp khoảng 5-10%.
Giá thành nguyên liệu sản xuất Antisense:
Việc nhắm đến tác dụng làm trở ngại RNAs không đóng vai trò liên quan
trực tiếp đến quá trình của protein là một hướng nghiên cứu y dược mới,
hứa hẹn một loại thuốc có cơ chế mới, sẽ chữa trị một cách hiệu quả cho
các bệnh di truyền hiểm nghèo.
Nhiều nghiên cứu trong phòng thí nghiệm (in vitro) gần đây cho thấy LNA
đã ức chế được sự tăng trưởng của nấm Candida albicans khi sử dụng hai
đoạn LNA dài 8 nucleotide và LNA/DNA dài 12 Nucleotide với nồng độ thấp
là 150 nanomole và 30 nanomole tương ứng.
LNA không những đã được dùng hữu hiệu trong việc thử nghiệm kháng vi
khuẩn, kháng ung thư, mà LNA còn có tác dụng gia tăng hoạt tính trong
các thuốc chẩn bệnh. Giá thành của nguyên liệu phosphoramidite
A,C,G,T(U) để sản xuất DNA, RNA, LNA đã được các hãng sản xuất cho biết
như sau:DNA phosphoramidites giá là 5 USD/gam, 2'Omethyl RNA giá là 35
USD/gam và RNA giá khoảng 80 USD/gam nếu mua với một lượng là hàng trăm
ký lô gam một lần. Giá này chỉ được dùng để bán hóa chất cho các công ty
lớn đang sản xuất Antisense. Các công ty hóa chất này thường bán với giá
gấp đôi với giá vừa nêu ra cho những công ty chỉ đặt mua khoảng 50 ký lô
gram một lần. LNA là hóa chất mới được tổng hợp phải trải qua nhiều quá
trình hóa học cần thiết và các công ty hóa chất chưa có quy trình sản
xuất thích hợp với một lượng là 100 gam, vì thế nếu đặt hàng là 5 gam
thì giá là 10,000 USD/gam.
Kết Luận:
Cho đến nay đã có nhiều nghiên cứu cho thấy miRNA có liên quan đến sự
phát triển của tế bào ung thư như C. elegans (lin-4) và Drosophila. Cũng
có nhiều nghiên cứu cho thấy việc dùng Antisense RNA tương ứng với các
miRNA này đã làm giảm được sự tăng trưởng của các tế bào ung thư này,
như tế bào ung thư Hela và 549. Trên 50% các miRNA đã được tách ly và
định tính từ các trung tâm phát bệnh ung thư. Zhang và cộng sự đã dùng
dãy phân giải cao (high resolution array), phép lai di truyền so sánh
(Comparative Genomic Hybridization, CGH) để phân tích cho thấy rằng
trong tổng số 41 miRNA Genes có khoảng 15% Genes đã được kiểm tra cho
thấy có các bản sao (copies) trong 3 loại ung thư chính: ung thư ngực
(Breast Cancer, ung thư tử cung (cervical cancer) và ung thư da
(melanoma). Ngành DNA Antisense đã được bắt đầu hơn 20 năm qua và hiện
đang chuyển sang một giai đoạn mới với siRNA, RNAi và miRNA. Hy vọng
Antisense RNA sẽ đưa chúng ta đến một giai đoạn công nghệ cao để tìm ra
phương pháp tri liệu các bệnh nan giải như bệnh ung thư.
Vũ Mạnh Huỳnh
Tiến Sĩ Hóa Học
©
http://vietsciences.free.fr
và http://vietsciences.org
Vũ Mạnh Huỳnh
|